2007-2008学年度第一学期期末考试九年级化学试题
http://www.newdu.com 2025/11/07 06:11:30 人民教育出版社 佚名 参加讨论
2007-2008学年度第一学期期末考试九年级化学试题 江苏省盐城市大丰市第四中学 肖 强 (满分70分时间70分钟) 可能用到的相对原子质量:H-1 C-12 O-16 S-32 Zn-65 Cu-64 一、选择题(本题共15小题,每小题只有一个正确答案,请将正确答案的序号填写在下表中。 每小题2分,共30分)
1.下列各图表示的变化中,只属于物理变化的是     A.火箭发射 B.煤的燃烧 C.风力发电 D.酸雨侵蚀 2.公安干警在缉毒行动中,训练有素的缉毒犬屡建奇功,它可以嗅出毒品的原因是 A.分子在不断运动 B.分子是可分的 C.分子体积极小 D.分子间有空隙 3.最近在我国河北省的海陆交界处发现了大储量的油田。油田中的石油属于 A.混合物 B.纯净物 C.单质 D.化合物 4.下列物质不属于溶液的是 A.生理盐水 B.消毒酒精 C.液氧 D.碘酒 5.“神舟6号”太空舱利用NiFe2O4将航天员呼出的CO2转化为O2,而NiFe2O4的质量和化学性质都不变。则NiFe2O4在该过程中是 A.反应物 B.生成物 C.消毒剂 D.催化剂 6.下列实验现象描述错误的是 A.铁丝在氧气中燃烧火星四射 B.硫在氧气中燃烧产生蓝紫色火焰 C.红磷在氧气中燃烧产生白雾 D.铝丝浸入硫酸铜溶液表面有红色物质生成 7.为延缓袋装食品变质,包装时不宜采用 A.真空包装 B.充入氧气 C.放入一小包铁粉 D.充入二氧化碳 8.房屋发生火灾时,消防队员用高压水枪喷水灭火,其主要目的是 A.隔绝空气 B.隔绝可燃物 C.改变可燃物性质 D.降低可燃物的温度 9.下列做法或认识科学的是 A.厨房煤气泄漏,立即打开排气扇电源 B.用硬水洗衣服比用软水洗效果好 C.防煤气中毒,煤炉上放一盆水 D.垃圾经分类回收处理可转化为资源 10.气相合成金刚石薄膜被誉为20世纪的炼金术。其中化学气相沉积法制造金刚石薄膜的原理为:CH4 →C(金刚石)+2H2 。该反应所属的基本反应类型为 A.化合反应 B.分解反应 C.置换反应 D.氧化反应 11.物质的用途与性质密切相关。下列说法不正确的是 A.铜用于制导线,是由于铜有良好的导电性 B.氮气常用作保护气,是由于氮气的化学性质不活泼 C.二氧化碳用于灭火,是由于二氧化碳不可燃、不助燃且密度比空气大 D.铁制品表面涂“银粉”(铝粉)防生锈,是由于铝的化学性质比铁稳定 12.有三瓶无色无味的气体,分别是氧气、空气、二氧化碳,区别它们最简单的方法是 A.测定气体的密度 B.伸入燃烧的木条 C.滴入澄清石灰水,振荡 D.滴入紫色石蕊试液,振荡 13.虾青素(C40H52O4)是一种具有极强的抗肿瘤、抗氧化性能的物质,可增强动物免疫力。下列有关它的说法正确的是 A.虾青素是一种氧化物 B.虾青素是由96个原子构成 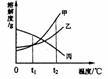 C.虾青素的相对分子质量是596 D.虾青素中碳、氢、氧元素的质量比为10:13:1 C.虾青素的相对分子质量是596 D.虾青素中碳、氢、氧元素的质量比为10:13:114.右图是甲、乙、丙三种物质的溶解度曲线,将甲、乙、丙三种物质tl℃时的饱和溶液升温至t2℃,所得溶液的溶质质量分数关系正确的是 A. 甲>乙>丙 B.甲=乙=丙 C. 甲=乙>丙 D.丙>甲=乙 15.乙烯(C2H4)是石油炼制的重要产物之一。常温常压时,乙烯是一种气体,它与另一种气体组成的混合物中碳元素的质量分数为87%,则另一种气体可能是 A.H2 B.C2H2 C.CH4 D.CO 二、填空题(每空1分,共19分) 16.从K、C、 S、H、O、N六种元素中选择适当的元素按要求填空。 (1)用适当的数字和符号填空: ①三个钾原子 ;②一个碳酸根离子 。 (2)写出符合下列要求的物质的化学式: ①固体俗称“干冰”的是 ;②溶于水使溶液温度显著降低的是 ; ③可用于炼铁的有毒气体是 。 17.同学们注意到了吗?随着现代化建设步伐的加快,我们的生活质量正在逐步提高。请你用所学的化学知识结合生活经验回答下列事例中的有关问题; (1)走进厨房,你会发现煤气罐被方便、价廉的管道天然气代替了,天然气属于 能源,其主要成分在空气中充分燃烧的化学方程式为 。 在厨房里,你还会发现用加了洗涤剂的水洗涤油腻的碗筷既快捷又干净,这是由于洗涤剂具有 功能。 (2)走进干洗店作社会调查时,你会了解到有些干洗店用装有活性炭的新款干洗机代替旧款干洗机,可将有毒物质大约降至原来的1/30。这是利用了活性炭的 性。 (3)走进加油站,你会发现除了各种型号的汽油之外,还多了乙醇汽油,至2008年1月1日,包括我市在内的苏北五市推广使用乙醇汽油已经二周年,提倡使用乙醇汽油的目的是 。 18.2007年10月20日,我国成功发射第一颗绕月探测卫星“嫦娥一号”。人类探月的重要目的之一是勘探、获取地球上蕴藏量很小而月球上却很丰富的核聚变燃料—“He-3”,解决地球能源危机.发射火箭常用高氯酸铵(NH4ClO4作燃料,其反应的化学方程式为: 2NH4C1O4 △ N2↑+Cl2↑+4x↑+2O2↑。试回答下列问题: (1)x的化学式为 ; (2)高氯酸铵(NH4ClO4)中氯元素的化合价为 ;  19.某同学用相同的铁钉探究铁生锈与哪些因素有关,设计的实验如图。经过一周观察:试管A和C中的铁钉无明显变化,试管B中的铁钉明显锈蚀。 19.某同学用相同的铁钉探究铁生锈与哪些因素有关,设计的实验如图。经过一周观察:试管A和C中的铁钉无明显变化,试管B中的铁钉明显锈蚀。(1)通过探究发现:铁生锈是铁与 和 共同存在时发生化学反应的过程。 (2)A中加入的蒸馏水要事先煮沸,其目的是 ; (3)通过探究,请你写出防止铁制品生锈的一种措施 。 20.若将一定量的铁粉投入到入一定量只含有Cu(NO3)2 、AgNO3 的工业废水中,充分反应后过滤,向所得滤渣中滴加稀盐酸,没有气泡产生,则滤渣中一定含有的金属是 ;一定不含有的金属是 。 三.实验题(每空1分,共16分)  21.请结合下列实验常用装置,回答有关问题。 21.请结合下列实验常用装置,回答有关问题。(1)写出图中标有字母的仪器名称: a 。 (2)若用高锰酸钾制取氧气,应选用的发生装置是 (填“A”、“B”或“C”),在加入药品前,应首先 ,加药品后试管口还应放置一团 ,反应的化学方程式是 。 (3)若要制取二氧化碳,在B装置中装有石灰石,那么a中应加入 (填写试剂名称),反应的化学方程式是 。 如果用E装置收集该气体,则气体从 端进入(填“b”或“c”)。 (4)实验室如用块状固体和液体无需加热制取难溶性气体,可将B装置改进为C装置(多孔隔板用来放块状固体),其优点是 。 22.实验室欲配制1 000 g溶质质量分数为4%的氢氧化钠溶液。请回答下列问题; (1)配制步骤 ①计算:需氢氧化钠固体 g,水 mL(水的密度是1 g/cm3)。 ③溶解:将氢氧化钠固体溶于水,用——搅拌,使氢氧化钠全部溶解,冷却至室温。 ④装瓶:把配好的溶液装入试剂瓶,盖好瓶盖并贴上标签,放入试剂柜中。 请在装有所配制溶液的试剂瓶(见右图)标签上标明相应的信息。 (2)在配制过程中,导致溶液中氢氧化钠质量分数小于4%的可能原因是( ) ①用量筒量取水时俯视读数;②配制溶液的烧杯用少量蒸馏水润洗;③在托盘天平的左盘称取氢氧化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数;④盛装溶液的试剂瓶用蒸馏水润洗;⑤氢氧化钠固体不纯。 A.①②③④⑤ B.只有①②④⑤ C.只有①②⑧ D.只有②③④⑤ (3)若老师提供的药品有500 g 8%的氢氧化钠溶液,500 g 1%的氢氧化钠溶液,足量的氢氧化钠固体和水,除了上述配制方案外,你还可以设计出哪些配制方案,请你写出其中的一种: .(只要说明配制时所需的各种药品及用量即可)。 四.计算题(共5分)  23.为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品20 g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止。反应过程中生成的气体与所用硫酸溶液的质量关系如右图所示。试计算: 23.为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品20 g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止。反应过程中生成的气体与所用硫酸溶液的质量关系如右图所示。试计算: (1)样品中铜的质量分数; (2)反应所消耗的硫酸溶液质量; (3)反应后所得溶液中溶质的质量分数。 2007-2008学年度第一学期期末考试 九年级化学试题参考答案及评分标准 一.选择题(每小题只有一个正确答案,每小题2分,共30分)
二.填空题(每空1分,共19分) 16.(1) ① 3K ②CO32- (2) ①CO2 ② NH4NO3 ③ CO 17.(1)化石(或“不可再生”或“清洁”) CH4+2O2 点燃 CO2 +2H2O 乳化 (2)吸附 (3)节约石油资源;减少环境污染;促进农业生产(答出其中任意一点即可)。 18.(1)H2O (2)+7 (+7价) (3)B 19.(1)氧气、水(或O2 、H2O ) (2)驱赶溶解在水中的氧气(或空气) (3)涂油、刷漆、镀上其它金属、制成合金等。(合理答案即给分) 20.Ag; Fe 三.实验题(每空1分,共16分) 21.(1)长颈漏斗 (2)A; 检查气密性; 棉花; 2KMnO4 △ K2MnO4 +MnO2 +O2↑,  (3) 稀盐酸 CaCO3 +2HCI=CaCl2 +H2O +CO2 ↑ b (3) 稀盐酸 CaCO3 +2HCI=CaCl2 +H2O +CO2 ↑ b(4)可以随时控制反应的发生(合理答案都对) 22.(1)① 40、 960 ② 左 ③ 玻璃棒 ④ (答案如右图)(名称和溶质质量分数两项全写且正确给1分) (2)D (3) 500 g8%的氢氧化钠溶液,再加500 g (或水500 g 1%的氢氧化钠溶液,再加35 g氢氧化钠固体和465 g的水) (答案不唯一,设计的方案中只要含有40 g的氢氧化钠和960 g水即可,但若只满足溶质质量分数为4%一个要求的不得分) 四.计算题(共5分) 23. (1)67.5%(1分) (2) 100 g (2分) (3)15.1% (2分) (责任编辑:admin) |