《酸和碱的中和反应》同步测试(第2课时)
http://www.newdu.com 2025/12/06 01:12:50 人民教育出版社 佚名 参加讨论
《酸和碱的中和反应》同步测试(第2课时) 石家庄第41中学 刘 萃 一、选择题 1.小华帮助家人科学种田,查阅有关农作物生长最适宜的pH范围:
他测知家乡的土壤pH接近7,你认为小华家最不适宜种植的农作物是( ) A.棉花 B.玉米 C.大豆 D.茶树 考查目的:pH的应用。 答案:D。 解析:茶树最适宜的pH范围5.0-5.5,和7.0相差较远。 2.某同学不小心被黄蜂蜇了一下(黄蜂毒液呈碱性),为了减轻疼痛可以涂抹( ) A.浓硫酸 B.食醋(pH=3) C.食盐水(pH=7) D.苏打或肥皂水(pH=9-10) 考查目的:中和反应的应用和pH的应用。 答案:B。 解析:利用酸碱中和可以涂弱酸性但没有强腐蚀性的物质。 3.经测定,某工厂排放的废水的pH为3,污染环境。若将该废水治理成pH为8时,可向该废水中加入适量的( ) A.氯化钠 B.硫酸 C.氧化钙 D.废铜片 考查目的:中和反应的应用和pH的应用。 答案:C。 解析:pH由3变为8需要加入可以和酸反应的氧化钙。 4.“雪碧”等碳酸型饮料的pH小于7,晃动后打开瓶盖,其pH将( ) A. 变大 B. 变小 C. 不变 D. 无法判断 考查目的:碳酸分解和pH的应用。 答案:A。 解析:碳酸不稳定,晃动后打开瓶盖会有部分分解,酸性减弱,所以pH变大。 5.下图X、Y、Z表示的是水、石灰水、稀盐酸的近似pH。下列判断错误的是( ) A.X是稀盐酸 B.Y是水 考查目的:溶液的pH。 答案:D。 解析:水、石灰水、稀盐酸的近似pH应该分别是7,>7, <7,据此可以确定X是稀盐酸,Y是水,Z是石灰水。 6.在生活生产和科学研究中,常用pH试纸测定溶液的pH。以下测定操作正确是( ) A.将被测液滴到放在玻璃片上的pH试纸上,显色后,与标准比色卡比较 B.将pH试纸直接投入被测液中,显色后,取出与标准比色卡比较 C.先用少量水湿润试纸,后滴上被测液,显色后,与标准比色卡比较 D.先用蒸馏水清洗滴管,随后吸取被测液滴到试纸上,显色后,与标准比色卡比较 考查目的:溶液的pH正确测定方法。 答案:A。 解析:将被测液滴到放在玻璃片上或者白瓷板上的pH试纸上,显色后,与标准比色卡比较,不能事先润湿试纸或滴管和玻璃棒,会将待测液稀释。 7.下列关于pH的说法正确的是( ) A.酸溶液的pH越大酸性越强 B. 碱溶液的pH大于7,盐溶液的pH等于7 C.测定溶液的pH时,需先将pH试纸湿润 D.测定人体内液体pH,可以了解人体健康状况 考查目的:溶液的pH。 答案:D。 解析:A酸溶液的pH越小酸性越强,B.碱溶液的pH大于7,盐溶液的pH不一定等于7,C测定溶液的pH时,不能将pH试纸湿润,D测定人体内液体pH,可以了解人体健康状况。 8.小明同学在实验室中测定某未知溶液的pH,他的实验操作如下:先用蒸馏水将pH试纸润湿,然后用玻璃棒蘸取待测试液于pH试纸上进行测定,你认为小明同学这样测得的结果与该溶液的实际pH比较( ) A.偏低 B.偏高 C.不变 D.无法判定 考查目的:溶液的pH的测定。 答案:D。 解析:润湿相当于稀释溶液。如果是中性溶液,润湿对结果无影响,如果是酸性溶液,润湿会使酸性减弱,从而pH变大,如果是碱性溶液,润湿会使碱性减弱,从而pH变小。 9.根据下列实验现象可以判断某溶液一定呈碱性的是( ) A.常温下,测得溶液的pH<7 B.溶液中滴入酚酞显红色 C.溶液中滴入石蕊显红色 D.溶液中滴入酚酞不显色 考查目的:溶液的pH以及指示剂的变色。 答案:B。 解析:溶液的pH<7说明溶液是酸性的,滴入石蕊显红色说明溶液是酸性,滴入酚酞不显色可能为酸性或中性。 10.某中学化学课外活动小组的同学,监测一次降雨过程中雨水的pH。取雨水水样,用pH计(测pH的仪器)测得数据如下:
小组同学对数据的分析推理错误的是( ) A.本次降雨通常会影响作物的生长 B.在测定期间雨水的酸性逐渐减弱 C.本次降雨对大理石建筑有腐蚀作用 D.当时空气中二氧化硫的含量可能超标 考查目的:溶液的pH 。 答案:B。 解析:在测定期间雨水的pH逐渐减小,酸性逐渐增强,有可能是二氧化氮或者二氧化硫造成的,酸雨会影响作物生长也会腐蚀大理石建筑。 二、填空题 11.肥皂水的pH>7,肥皂水呈_____性,能使无色酚酞溶液变_______色;白醋的pH ,白醋呈酸性,能使紫色石蕊溶液变_____色;溶液的pH越______,则溶液的酸性越强;溶液的pH越大,则溶液的碱性越 。 考查目的:溶液的pH 。 答案:碱 红 <7 红 小 强。 解析:pH可以表示溶液酸碱度,pH=7为中性,pH<7为酸性,且越小酸性越强,pH>7为碱性,且越大碱性越强。 12.下图是氢氧化钠溶液和盐酸用滴加方式反应时, 溶液pH 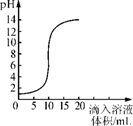 (1)氢氧化钠和盐酸恰好完全反应时,溶液的pH 7 (填“大于”或“小于”或“等于”)。 (2)根据曲线判断,该反应是将(填“氢氧化钠溶液”或“盐酸”,下同)滴入中, 理由是 。 (3)当滴入溶液的体积为5mL时,所得溶液中的溶质为(写化学式),若在此溶液中滴入石蕊溶液,溶液显 色。 考查目的:溶液的pH以及中和反应。 答案:(1)等于(2)氢氧化钠溶液 盐酸 原溶液pH <7,显酸性,并且溶液pH逐渐增大到大于7,呈碱性 (3) NaCl和HCl 红。 解析:pH可以表示溶液酸碱度,pH=7为中性,pH<7为酸性,且越小酸性越强,pH>7为碱性,且越大碱性越强。当滴入溶液的体积为5mL时,pH<7,所得溶液成酸性,也就是酸过量,所以溶液中的溶质为NaCl和HCl。 (责任编辑:admin) |
- 上一篇:《溶液的形成》同步测试(第1课时)
- 下一篇:《金属和金属材料》单元测试