湖北五峰一中2011—2012学年度第一学期九年级化学期末检测试卷
http://www.newdu.com 2025/12/09 01:12:06 人民教育出版社 佚名 参加讨论
湖北五峰一中2011—2012学年度第一学期九年级化学期末检测试卷 湖北五峰一中 唐丽华 注意事项: 本试卷分试题卷和答题卡两部分,其中试题6页,答题卡2页;请将答案写在答题卡上每题对应的答题区域内,写在试题卷上无效。 可能用到的相对原子质量:H~1 C~12 O~16 Cl~35.5 Zn~65 一、选择题(本题共16小题。每小题只有一个选项符合题意。,每小题2分;共32分) 1. 空气的成分中体积分数大约为0.94%的是 A. 氮气 B. 氧气 C. 二氧化碳 D. 稀有气体 2. 下列生活常用水中,属于纯净物的是 A. 矿泉水 B. 自来水 C. 河水 D. 浮有冰的水 3.下列是日常生活中常发生的一些变化,其中属于化学变化的是 A. 水受热沸腾 B.剩饭变馊 C. 汽油挥发 D. 西瓜榨成汁 4.以下是四种常见的危险品标志,在装运乙醇的包装箱上应贴的标志是 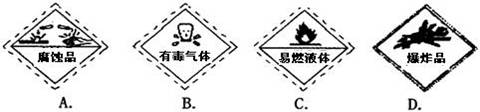 5. 据报道,美国宇航局的专家发明了“月球制氧机”,这种“月球制氧机”利用聚焦太阳能产生的高温使月球土壤发生化学反应制取氧气,据此可推测月球土壤中一定含有 A. 氧元素 B. 氧气 C. 水 D. 高锰酸钾 6.下列实验操作正确的是 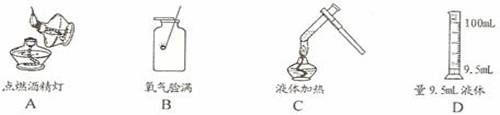 7.在“人吸入的空气和呼出的气体有什么不同的探究”中,下列说法不正确的是
8.从防止污染和温室效应、保持可持续发展考虑,下列能源不应大力开发的是  A.太阳能 B.风能发电 C.水能发电 D.火力发电 9. “生命可贵,安全第一”。下列采取的安全措施错误的是 A.为防止饮用水中含有杂质、细菌等危害人体健康,生活中最好饮用蒸馏水 B.厨房煤气管道漏气,立即关闭阀门并开窗通风 C.做甲烷燃烧实验前,应先检验甲烷的纯度 D.进入久未开启的菜窖,先用蜡烛做灯火实验 10.Y2BaCu6O10是一种高温超导材料。该化合物中,Y元素的化合价为+3价,则铜元素的化合价为 A.0价 B.+1价 C.+2价 D.+3价 11.下图是用比例模型来表示物质间发生化学变化的微观示意图: 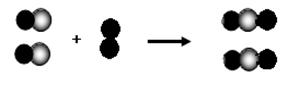 图中“  ” 分别表示两种元素的原子,下列化学反应能用该图表示的是 ” 分别表示两种元素的原子,下列化学反应能用该图表示的是  12.在食盐中加入KIO3有益于防治地方性甲状腺肿大。检验食盐中是否含有碘酸钾,可利用化学反应: A. KI B. HI C. 13.学习物质性质时,我们常对物质从不同的角度进行分类.现有某同学将氢气、一氧化碳、铁、红磷、水、二氧化碳共六种物质进行如下分类,其分类及依据不完全正确的是
14.虾青素(C40H52O4)是一种具有极强的抗肿瘤、抗氧化性能的物质,少量添加到饲料中,可增强动物免疫力。下列有关它的说法正确的是 A.虾青素是由96个原子构成 B.虾青素是一种氧化物 C.虾青素的相对分子质量是596 D.虾青素中碳、氢、氧元素的质量比为10︰13︰1 15.根据下列四种粒子的结构示意图,所获取的信息不正确的是  ① ② ③ ④ A.它们表示三种元素 B. ②③的化学性质相同 C.②表示的元素是金属元素 D.①表示的是原子,而④表示的是阴离子 16.下列知识的归纳中,有错误的一组是
二、填空题(共4小题,化学方程式每个3分,其余每空1分,共21分) 17.(1) 用化学符号或化学式填空::2个氮原子 17 ; 3个氧化铁分子 18 ; 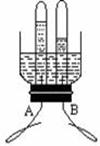 (2) 归纳:H2、、H2O、H2SO4中数字“2”的含义是 19 。 (2) 归纳:H2、、H2O、H2SO4中数字“2”的含义是 19 。18.水是人类生活中不可缺少的物质。 (1)净水时,通常用 20 的方法,除去水中难溶性杂质,常用 21 做吸附剂除去水中的色素和异味。 (2)小花同学设计了电解水简易装置,其中A、B电极由金属曲别针制成。通电后的现象如图所示。与A电极相连的试管中收集到的气体是 22 ;电解水的化学方程式为: 23 。 (3)自来水中含有少量Ca(HCO3)2等可溶性化合物,烧水时Ca(HCO3)2发生分解反应,生成难溶性的碳酸钙、水和二氧化碳,这就是壶中出现水垢的原因之一。Ca(HCO3)2受热分解的化学方程式为: 24 。 19.(1)燃料是重要的能源,若使用不当对环境会造成不良影响。沼气是农村常用的燃料之一,它的主要成分的化学式是 25 ; (2)我国科学家研究表明,在440 ℃和800大气压条件下,二氧化碳和金属钠反应产生金刚石和碳酸钠,合成的金刚石可以满足工业上的需要。该反应的化学方程式是: 26 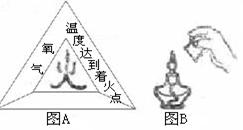 20.燃烧是我们生活中常见的现象: 20.燃烧是我们生活中常见的现象:(1)燃烧的条件可用图A所示的“火三角”表示,其中缺少的一个条件是 27 ;点燃篝火时,常将木柴架空以促进燃烧,是利用了增大 30 的方法。 (2)图B中熄灭酒精灯依据的灭火原理是: 28 ;酒精(乙醇)燃烧的化学方程式是: 29 。 三、简答(说明)题(共4小题,化学方程式每个3分,其余每空1分,共15分) 21.“  ” ,从这一角度分析木炭的有关知识(只要从一个方面叙述): ” ,从这一角度分析木炭的有关知识(只要从一个方面叙述):从物理性质分析: 31 ;从化学性质分析: 32 。 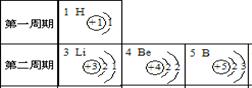 22.右下图是元素周期表中部分元素的原子结构示意图。据此研究下列问题: 22.右下图是元素周期表中部分元素的原子结构示意图。据此研究下列问题:(1)原子序数为3的元素属于 33 (填金属、非金属)元素,在化学反应中,该元素的原子容易 34 电子,变成 35 (填符号); (2)从第二周期(横行)分析从左到右每种元素原子的最外层电子数依次递增,但元素原子的电子层数 36 ; (3)从第一族(纵行)发现 37 。 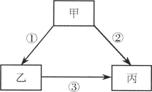 23.甲、乙、丙表示初中化学中常见的三种物质,其中一种物质为单质,另外两种物质的组成元素相同。其转化关系如右图所示:若甲为_ 38 __(填化学式),其相应的任意一个反应的化学方程式是:_ 39 _。 23.甲、乙、丙表示初中化学中常见的三种物质,其中一种物质为单质,另外两种物质的组成元素相同。其转化关系如右图所示:若甲为_ 38 __(填化学式),其相应的任意一个反应的化学方程式是:_ 39 _。24.某同学在学习中对化学知识有如下一些认识:“①镁条燃烧后总质量增大,因此该反应不遵循质量守恒定律;②氧化反应不一定是化合反应;③组成元素相同的物质一定具有相同的性质;④分子构成的物质一定是单质”。其中有些说法不正确,请在下表中发表看法:
四、简答(分析)题(共2小题,化学方程式每个3分,其余每空1分,共13分) 25.在一个密闭容器中放入A、B、C三种物质各25g,在一定条件下发生化学反应,充分反应后,测得有关数据如下:
在此化学反应中,各物质之间的质量比是 44 ,反应类型是 45 。 26.实验室常用下列装置制取气体,根据所学知识回答下列问题: 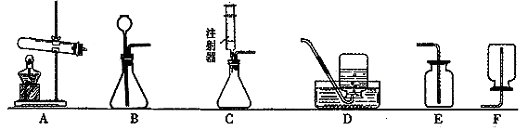 (1) 实验室用A、B装置都可以制取氧气,用B装置制取氧气的化学方程式是: 46 ;B装置还可以用来制取 47 ,该反应的化学方程式是: 48 。 (2) 实验室用过氧化氢溶液和二氧化锰粉末混合来制取氧气,选C做气体发生装置,其优点是 49 。 (3) 汽车尾气中的一氧化氮是一种大气污染物。它是一种无色气体,难溶于水,密度比空气略大,在空气中能与氧气迅速反应生成红棕色的二氧化氮气体。实验室中制取一氧化氮采用的收集装置是(填序号) 50 。 (4) 选择气体的发生装置时,应该考虑的因素有: 51 。甲烷是最简单的有机物类的气体,实验室常用加热醋酸钠与氢氧化钠固体混合物来制得。实验室制取甲烷应选用的发生装置是(填序号) 52 。 五、简答(探究)题(共1小题, 化学方程式每个3分,其余每空1分,共12分) 27.化学实验中有很多规律值得我们总结、归纳和拓展应用: (1)探究实验归纳一
(2)探究实验归纳二
(3)实验设计拓展: 已知二氧化碳能与氢氧化钙溶液发生反应,此反应由于有白色沉淀生成,能证实此反应已经发生;二氧化碳也能与氢氧化钠溶液发生相似的反应,但此反应由于生成物溶于水,不能观察到反应是否发生。小明同学通过设计一个对比实验,得出结论:二氧化碳能与氢氧化钠溶液发生的反应。请完成下表中小明同学设计的对比实验方案,并填写实验现象:
此反应的化学方程式是: 60 六、计算题(共2小题,第28小题2分,第29小题5分,共7分) 28.“达菲”是目前世界上预防甲型H1N1流感的良方之一。生产药品的主要原材料是我国传统香料八角茴香中所含的莽草酸。根据莽草酸的化学式(C7H10O5)计算: (1) 莽草酸中碳元素、氢元素和氧元素的质量比为: 61 ; (2) 174 g莽草酸中含有 62 g氧元素。 29.小明同学在实验室称取了13g锌,放在盛有足量稀盐酸的烧杯中进行充分反应,试计算反应共生成氢气多少克?生成氯化锌多少克?(反应的化学方程式是:Zn + 2HCl = ZnCl2 + H2↑) 参考答案 一、选择题(本题共16小题。每小题只有一个选项符合题意。每小题2分;共32分)
二、填空题(共4小题。化学方程式每个3分,每空1分,共21分) 17.(1)2N; 3Fe2O3 (2)一个分子所含的原子数 18.(1)过滤; 活性炭 氧气(或O2) (2)2H2O (3)Ca(HCO3)2 19.(1) CH4; (2) 4Na + 3CO2 ===== C + 2Na2CO3 20.(1) 可燃物; 隔绝氧气(或空气); (2) C2H5OH+3O2 三、简答(说明)题(共4小题,化学方程式每个3分,其余每空1分,共15分) 21.木炭粉疏松多孔,它具有吸附能力,故可以作吸附剂;木炭具有还原性,故可以用来还原金属氧化物;(说明:只要性质和用途对应就给分) 22.(1) 金属; 失去; Li+ (2)不变 (3) 最外层电子数相同或从上到下电子层数递增。 23. C(说明:或O2或其它合理答案均可) 2CO + O2 24.① 镁条的质量与氧气的质量总和等于氧化镁的质量,符合质量守恒定律(说明:或其他事例) ③ 金刚石与石墨的物理性质差异很大(说明:或其他事例);或④ 水是化合物,但它是分子构成的(或其他事例)。(说明:以上四空其他合理答案均可)。 四、简答(分析)题(共2小题,化学方程式每个3分,其余每空1分,共14分) 25. C:B:D===25:3:22 分解反应 26.(1) 2H2O2 2HCl + CaCO3=== CaCl2 + H2O+ CO2 ↑ (2) 便于控制反应速率 (3) 排水集气法 (4) 反应物的状态和反应条件 A 五、简答题(共1小题, 化学方程式每个3分,其余每空1分,共12分) 27.(1) 分子在不断的运动 多种实验方案得到同一个实验结论; (2) 略 (说明:任意一个探究物质性质的实验均可) 略 (说明: 此表中任意一个实验反应的化学方程式正确即可) 通过化学实验可以得出或者验证物质的性质。 (3) 将两个等体积的软塑料瓶里分别充满二氧化碳气体,然后分别注入等体积的水和氢氧化钠溶液。(说明:设计没有对比性的不得分) 注入氢氧化钠溶液的软塑料瓶变瘪的程度比注入水的软塑料瓶大。 CO2+2NaOH====Na2CO3 +H2O 六、计算题(共2小题,第28小题2分,第29小题5分,共7分) 28.(1) 84:10:80(或42:5:40) (2):80 29.解:设反应生成氢气的质量为x,生成氯化锌的质量为y。 Zn + 2HCl = ZnCl2 + H2↑ 65 136 2 13g y x …………1分(做到此处无误得1分) 65/13 g=2/x 65/13 g=136/y …………2分(两个比例式列对得2分) X=0.4 g y=27.2 g …………2分(计算正确各得1分) 答:反应后共生成氢气0.4 g,生成氯化锌27.2 g。 (说明:解答中“设”和“答”不全者此题扣1分,“设”和“答”不另外给分) (责任编辑:admin) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

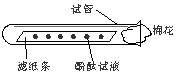
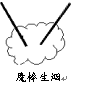 用两根分别蘸有浓氨水和浓盐酸(HCl)的玻璃棒相互接近
用两根分别蘸有浓氨水和浓盐酸(HCl)的玻璃棒相互接近 ①铁丝在氧气中燃烧
①铁丝在氧气中燃烧