|
【命题的由来】 学生已经学完了有关二氧化碳的实验室制法、性质和用途,与二氧化碳相似的二氧化硫这种气体因与酸雨形成有关也常常作为热点问题被命题者所关注。此类实验探究题对拓宽学生知识领域、提高学生学习兴趣、考核学生灵活运动化学基础知识、理论联系实际的解题能力均有良好的效果。由于该类题目考查内容广泛,立意新颖,具有起点高,落点低,区分度好的优点,是中考热点之一。鉴于此,创作了此类习题。 【命题新探一】 材料一实验室里可用固体亚硫酸钠(Na2SO3)和稀硫酸在常温下通过复分解反应(属于固液常温反应),也可采用金属铜与浓硫酸在加热时制得二氧化硫(属于固液加热反应,制得气体较纯)。 材料二二氧化硫是无色具有刺激性气味的气体,密度比空气大且能溶于水,其水溶液为亚硫酸。亚硫酸不稳定,易分解为二氧化硫和水。二氧化硫能使紫色石蕊试液变红色,也能使高锰酸钾溶液或溴水褪色。二氧化硫通入品红溶液,品红褪色,加热又呈现红色,说明二氧化硫具有漂白性。 根据以上资料和所学的知识,请你回答下列问题: (1)二氧化硫的物理性质(任答两条) 、 。 (2)制取二氧化硫气体所需的发生装置(填字母) 或 ,收集装置 。 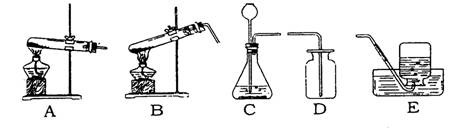 (3)在收集完气体后应将多余的二氧化硫气体通入NaOH溶液(即尾气处理),请你写出这样做的原因 (用化学方程式表示)。 (4)若在上述实验中气体无法收集满,则可能的原因是 。 (5)你所学过的知识中,C装置还可以用来做 的实验(举一例即可),写出制取该气体的化学方程式______________________。 (6)某同学错将稀盐酸代替稀硫酸,欲制取纯净、干燥的二氧化硫做性质实验,净化装置中应用 溶液除去盐酸挥发出来的氯化氢气体,干燥装置中应用 除去水蒸气。 (7)请你对上述实验室制取二氧化硫的两种方法进行评价(写出两点即可) ; 。 【命题新探一解答】 (1) 气体密度比空气大、易溶于水(或有刺激性气味的气体) (2) C或B;D (3) SO2+2NaOH=Na2SO3+H2O (4)装置的气密性不完好 (5)CO2(或H2,或O2) CaCO3+2HCl=CaCl2+H2O+CO2↑(或Zn+H2SO4 =ZnSO4+H2↑,或2H2O2 (6)饱和的亚硫酸氢钠 P2O5固体或浓硫酸 (7)①固液常温反应相对安全,但反应较快,不易控制,且生成的二氧化硫与水反应生成亚硫酸;②固液加热反应相对安全不高,由于有水生成也使硫酸浓度降低而影响反应速率,但因浓硫酸有吸水性使制取的二氧化硫纯度较高。(其它合理答案都对) 【命题新探二】 某化学活动小组学完酸雨的形成及其危害后,知道二氧化硫是导致酸雨的主要气体之一,对二氧化硫气体产生了浓厚兴趣,对此进行了探究。 [提出问题] 实验室如何制取二氧化硫?能不能像实验室制取二氧化碳那样用CaSO3与酸起反应来制取呢? [猜想与假设] 猜想①:CaSO3与HCl反应(CaSO3+2HCl=CaCl2+H2O+SO2↑); 猜想②:CaSO3与H2SO4反应(CaSO3+ H2SO4=CaSO4+H2O+SO2↑); 猜想③:Na2SO3与HCl反应(Na2SO3+2HCl=2NaCl+H2O+SO2↑); 猜想④:Na2SO3与H2SO4反应(Na2SO3+ H2SO4=Na2SO4+H2O+SO2↑); 猜想⑤:…… [收集证据] (一)查阅有关资料: 1.二氧化硫是无色具有刺激性气味的气体,密度比空气大且能溶于水,其水溶液为亚硫酸。亚硫酸不稳定,易分解为二氧化硫和水。二氧化硫能使紫色石蕊试液变红色,能使溴水、高锰酸钾溶液褪色。二氧化硫通入到1%的品红溶液中,品红褪色,加热又呈现红色,说明二氧化硫具有漂白性。 2.学完二氧化碳的知识后已经知道:盐酸特别是浓盐酸具有挥发性,使制得的气体不纯;硫酸钙是微溶的,时间长了会隔绝与酸的接触,阻碍反应的进一步进行。 (二)实验探究: 针对上面的猜想①至猜想④,化学活动小组依次设计了实验方案,进行了实验验证。请你将他们设计的可行的实验探究方案和实验现象,填写在下表中。(已经准备好相应的仪器和药品)
[得出结论] 。 [反思与评价] (1)有同学认为猜想②的验证存在漏洞,你认可(或不认可)的理由是 。 (2)实验室不用猜想①②③制取二氧化硫的原因 。 [交流与应用] 凡事应该一分为二的去看待,二氧化硫有害也有用。你认为二氧化硫在生活中的作用为(写出一条即可) 。 【命题新探二解答】 1.填表:(答案不唯一)
[得出结论]: 实验室里可采用亚硫酸钠(Na2SO3)固体和稀硫酸在常温下发生反应制得二氧化硫(Na2SO3+H2SO4=Na2SO4+H2O+SO2↑);二氧化硫与二氧化碳具有相似的化学性质,但不完全相同。 [反思与评价]: (1)认可的理由,使紫色石蕊试液变红色的不一定就是二氧化硫气体,因为二氧化碳气体也有此性质(不认可的理由,猜想中已经说明是CaSO3与H2SO4反应,产生的气体一定是二氧化硫)。 (2)盐酸特别是浓盐酸具有挥发性,使制得的气体不纯;硫酸钙是微溶的,时间长了会隔绝与酸的接触,阻碍反应的进一步进行。 [交流与应用]: 二氧化硫具有漂白作用。生活中常用二氧化硫漂白纸浆、毛、丝、草编制品(如草帽)等(或二氧化硫还能够杀灭霉菌和细菌,可以用作食物和干果的防腐剂)。 【点评】 综合分析近几年的全国各地中考化学实验探究试题不难发现,较常见的命题点有:(1)提出合理猜想或假设;(2)制定探究实验方案;(3)填写实验现象和结论;(4)进行反思和评价等。另外,还有些地区将探究实验与计算融合一起进行综合考查要求解答。笔者针对命题点提出了下列六个方面的应对策略。 1.在应对“提出问题”方面 仔细阅读信息题干,领会题意,弄清探究的目的,并提出相关的问题。这是解题的关键点,因为其他所有环节都建立在此基础之上。应注意提出的问题应针对课题而言并能比较清楚地表述所发现的问题,应具有针对性和有效性,防止过于简单或与主题无关变成一种形式而不值得去探究。 2.在应对“提出合理猜想或假设”方面 只有“大胆猜想或假设”才能提出有意义的研究方向,发现创新性问题,没有革旧布新的勇气和胆略是做不出科学发现和创新性成果的。在弄清了探究的目的之后,能主动地或在他人的启发下对提出问题可能的答案作出猜想或假设,并具有依据已有的知识和经验对猜想或假设作初步论证的意识。但有时猜想或假设不止一个,这时应选择可能性最大且有利于自己进行探究设计的去猜想或假设。 3.在应对“制定探究实验方案”方面 在设计探究实验方案时,要根据自己已有的知识,制定出理论上合理、实际上可行、操作上简便、安全、经济环保的计划,选择合适的仪器、药品,设计出合理装置和操作步骤。要善于采取回忆、对比、分析、归纳等过程中形成实验的一般思路和方法。因此,在作答时要注意像仪器组装应按照由里到外、由下至上、从左到右的顺序进行,选择制取气体的发生装置(固—固加热装置、固—液不加热或加热装置)应根据反应物的状态及反应条件;确定收集装置(排水法、排气法)应根据气体的性质等,然后自己设计实验方案,独立地进行探究。 4.在应对“实验现象和结论”方面 实验现象是针对所设计的实验要进行仔细地观察并准确地描述,而实验结论是对实验现象分析、归纳、总结而得出来的,是对猜想和假设的一个判断和回答。这就要求学生熟记常见物质的性质和用途。像在实验室制备的各种气体(如氧气、氢气和二氧化碳等)中,常规考查在于反应原料、反应原理、反应条件、收集方法、验证方法、验满方法、注意事项等几个方面,拓展考查在于制取的气体中常含有少量的酸雾、水蒸气和其他气体杂质,为了得到干燥、纯净的气体,常用固体干燥剂有碱石灰或氢氧化钠(被干燥的气体有O2、H2、CH4、NH3、CO等)、无水硫酸铜(检验并除去水蒸气),常用的液体干燥剂有浓硫酸(被干燥的气体有O2、H2、CH4、CO、HCl、CO2、SO2、SO3等)。例如,实验室制取二氧化碳是否混有氯化氢气体,检验方法是用硝酸银溶液,除去方法是用饱和的碳酸氢钠(或碳酸钠)溶液;某气体是否混有二氧化碳,检验方法是用澄清石灰水,除去方法是用氢氧化钠溶液,等等。 5.在应对“反思与评价”方面 在实验完成之后,反思整个实验过程,对实验方案、实验操作、实验结论的正确性和准确性进行正确的评价,通过交流活动,发表自己的探究成果和方法、倾听他人的探究经验的过程中进行客观的比较和鉴别,从不同的角度改进自己的经验和认识,克服原先独立探究中的片面性和局限性,获得某种启发或提出更加合理化的建议,最终完成对所学知识意义的完整建构。 6.在应对“延伸和拓展知识”方面 命题者常将与O2、H2、CO2等相类似的H2S、SO2、CH4、NH3等就制取、性质、用途进行深化、拓展和延伸,或在实验中找到新的发现点和知识点,或与此实验相关联的物质替代品等进一步拓展探究。这就要求学生最好先看问题,带着问题去捕捉所给资料中的有效信息,并运用所学知识或知识迁移来解决实际问题。 (责任编辑:admin) |
