|
《溶液》单元测试B 天津市滨海新区塘沽第六中学 冯 聪 天津市滨海新区塘沽教育中心 康永军 一、选择题 1.将下列厨房中常用的调味品,分别与足量的水充分混合后,形成的混合物属于溶液的是( )。 A.花生油 B.食盐 C.面酱 D.五香粉 考查目的:溶液的概念、组成及其特征;溶解现象与溶解原理。 答案:B。 解析:能形成均一、稳定的混合物才是溶液,与水能形成溶液的物质一定是能溶于水的物质。花生油、面酱、五香粉不溶于水;食盐可溶于水,与水混合能形成均一、稳定的混合物,故选B。 2.下列洗涤所用物质不具有乳化功能的是( )。 A.用汽油除去衣服上的油污 B.用洗洁精清洗餐具上的油污 C.用肥皂液洗衣服 D.用洗发液洗头发 考查目的:乳化现象与乳化作用。 答案:A。 解析:根据汽油是良好的有机溶剂,能溶解油脂,以及洗涤剂中有乳化剂,具有乳化功能判断,生活中的洗洁精、肥皂液、洗发液等都是乳化剂。 3.下列哪种方法不能用于分离饱和溶液中的溶质和溶剂( )。 A.静置 B.蒸发 C.降温 D.蒸馏 考查目的:对饱和溶液的理解,判断溶液是否饱和。 答案:A。 解析:静置只能分离可溶物与不溶物;蒸发和降温是结晶的常见方法;蒸馏实质上就是蒸发掉水,所以选A。 4.20 ℃时,向一只烧杯中加入100 mL水,再加入1 g Ca(OH)2固体,搅拌,静置,有白色沉淀沉降到烧杯底部。下列对于上层澄清液体的说法,错误的是( )。 A.是无色溶液 B.是不饱和溶液 C.是饱和溶液 D.溶质是Ca(OH)2 考查目的:饱和溶液和不饱和溶液;溶液中溶质、溶剂的分析。 答案:B。 解析:A选项,Ca(OH)2溶液是无色溶液;B选项,溶液底部仍然有Ca(OH)2固体,所以上层清液是饱和溶液;D选项,上层清液中溶质是Ca(OH)2。 5.下列关于氯化钠溶解度的说法正确的是( )。 A.100 g水中溶解30 g NaCl达到饱和状态,则NaCl的溶解度为30 g B.20 ℃时,可把30 g NaCl溶解在100 g水中,所以20 ℃时,NaCl的溶解度为30 g C.20 ℃时,把30 g NaCl溶解在水里制成饱和溶液,所以20 ℃时,NaCl的溶解度为30 g D.20 ℃时,100 g水中溶解36 g NaCl恰好达到饱和,则20 ℃时NaCl的溶解度为36 g 考查目的:溶解度的定义。 答案:D。 解析:溶解度指的是一定温度下,某物质在100 g溶剂中达到饱和状态时所溶解的质量。 6.下图是某物质的溶解度曲线。60 ℃时,取100 g水配制成该物质的饱和溶液,当温度降至30 ℃时所得溶液的质量为( )。 A.130 g B.140 g C.160 g D.180 g  考查目的:认识溶解度曲线。 答案:B。 解析:该物质的溶解度随温度的升高而升高,因此30 ℃时所得溶液一定为饱和溶液,又知溶剂质量为100 g,故选B。 7.下列溶液中溶质的质量分数最大的是( )。 A.10 g溶质溶于100 g水中 B.10 g溶质配成100 mL溶液,该溶液的密度是1.15 g/cm3 C.100 g 25%的某溶液加水稀释到200 g D.100 g 10%的某溶液,又溶解了10 g溶质 考查目的:溶质质量分数的计算。 答案:D。 解析: 8.向氯化钠饱和溶液中,逐渐加入氯化钠固体(不考虑溶解时的热量变化),边加边搅拌。下列图形中变化关系正确的是( )。 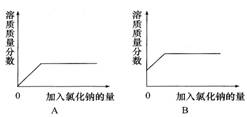 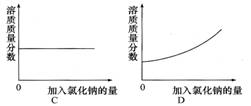 考查目的:对饱和溶液的理解。 答案:C。 解析:氯化钠溶液已经饱和,不能再继续溶解氯化钠,溶质质量和溶液质量均不发生改变,因此溶质质量分数不变。 9.用25%的NaOH溶液和5%的NaOH溶液混合,配置10%的NaOH溶液,混合时两种溶液的质量比是( )。 A.3∶1 B.1∶3 C.1∶5 D.5∶1 考查目的:溶质质量分数的概念及计算。 答案:B。 解析:设二者溶液质量分别为x、y,根据混合前后溶质质量之和相同列方程:25%x+5%y=10%(x+y),则x∶y=1∶3。 10.有m g 15%的硝酸钠溶液,欲使其质量分数增加一倍,可采用的方法是( )。 A.蒸发掉溶剂质量的 B.蒸发掉溶剂 C.加入 D.加入 考查目的:溶质质量分数的概念及计算。 答案:B。 解析:B中溶质不变,溶液质量变为原来的一半,故质量分数增加一倍。 二、填空题 1.蔗糖(C12H22O11)和食盐均能溶于水形成溶液,在蔗糖溶液中,溶质的微粒是 ,而食盐溶液中溶质的微粒是 。 考查目的:对物质溶解过程的理解。 答案:蔗糖分子 氯离子和钠离子。 解析:蔗糖是由蔗糖分子构成的,在水分子作用下,蔗糖分子均一地分散到水分子中间;氯化钠是由钠离子和氯离子构成的,在食盐溶液中,氯化钠以钠离子和氯离子的形式存在。 2.下图是A、B两种物质的溶解度曲线,根据图示回答下列问题: 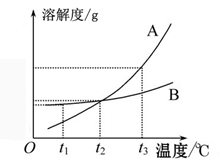 (1)t1 ℃时,向两只盛有100 g 水的烧杯中,分别加入A、B两种物质至不能溶解为止,所得溶液中溶质的质量分数较大的是溶液__________(填“A”或“B”)。 (2)t3 ℃时,欲配制等质量的A、B两种物质的饱和溶液,所需水的质量关系为:A溶液_____B溶液(填写“>”“<”或“=”,下同)。 (3)将t3 ℃的A、B两种物质的饱和溶液各200 g,降温至t2 ℃,析出晶体的质量关系为:A溶液____B溶液。 考查目的:溶解度曲线与饱和溶液、溶液的浓度的关系。 答案:(1)B (2)< (3)> 解析:(1)同温下溶液处于饱和状态时,溶解度越大,溶质的质量分数越大;(2)t3 ℃时,A的饱和溶液中溶质的质量分数大于B的饱和溶液中溶质的质量分数,因此等质量的A、B饱和溶液中,A所含的水质量少;(3)t3 ℃时A、B两种物质等质量的饱和溶液中,A溶液中的溶质质量较大;t2 ℃时A、B等质量的溶液中,溶质质量相等,因此A溶液析出晶体质量大于B溶液。 13.物质A的溶解度曲线如下图所示,请根据曲线回答下列问题: 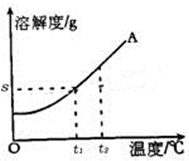 (1)t1 ℃时,A的饱和溶液中溶质质量与溶液质量之比为 ; (2)若将A的饱和溶液从t2 ℃降温到t1 ℃时,一定不会发生改变的是 。 A.溶解度 B.溶剂质量 C.溶质质量 D.溶质质量分数 考查目的:溶解度曲线的应用。 答案:(1)s:(100+s) (2)B 解析:(1)从溶解度定义可得;(2)A的饱和溶液从t2 ℃降温到t1 ℃,溶解度减小,溶质析出,溶质质量分数减小,而溶剂质量不变。 4.实验室需配制一定质量分数的硝酸钾溶液: (1)查阅硝酸钾的溶解度。已知,20 ℃时,硝酸钾的溶解度为31.6 g,在该温度下配制硝酸钾溶液,溶质的质量分数最大为 %(计算结果保留整数)。 (2)计算。配制40 g质量分数为10%的硝酸钾溶液,所需硝酸钾的质量为 g,所需蒸馏水的体积为 mL(水的密度近似看做1 g/mL)。 (3)称量。分别在天平左右两盘放上纸片,调节平衡后, (填字母)。 A.先移动游码到所需位置,再添加硝酸钾直到天平平衡 B.先添加所需的硝酸钾,再移动游码直到天平平衡 (4)量取。量取所需蒸馏水要用到的仪器是 (填字母)。  (5)溶解。将称量好的硝酸钾和蒸馏水混合溶解。 考查目的:溶质质量分数的计算和溶液的配制。 答案:(1)24 (2)4 36 (3)A (4)B C 解析:(1)31.6 g÷131.6 g×100%=24%;(2)40 g×10%=4 g;40 g-4 g=36 g;(3)使用托盘天平称量一定质量的固体,调平后,应先调节砝码、游码,再加药品;(4)量取液体应用量筒和胶头滴管。 5.(2013年揭阳市)将20 g含杂质(杂质不溶于水,也不溶于酸)的锌样品,与一定质量的稀硫酸恰好完全反应,所得溶液质量为80.5 g,同时生成氢气0.4 g。试计算: (1)样品中锌的质量为 g。 (2)完全反应后所得溶液中溶质的质量分数。 考查目的:溶质质量分数与化学方程式相结合的计算。 答案:(1)13 (2)40% 解析:(1)根据氢气质量计算锌的质量为13 g; (2)解:设完全反应后所得溶液中溶质的质量为x。 Zn + H2SO4 = ZnSO4 + H2 ↑ 161 2 x 0.4 g 161/x = 2/0.4 g x = 32.2 g 完全反应后所得溶液中溶质的质量分数为: 32.2 g/80.5 g×100% = 40% (责任编辑:admin) |
