|
2008年江西省初中学生化学素质和实验能力竞赛初赛试题
试卷说明:1、本试卷共8页,满分100分。考试时间:120分钟 2、可能用到的相对原子质量: H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5 K-39 Ca-40 Fe-56 Cu-64 Zn-65
一、选择题(本题15小题,每小题2分,共30分。每小题有1~2个选项符合题意。若有两个答案的错选1个不得分,漏选一个扣1分。请将答案填在下表相应的空格内)
1、污水处理的主要方法有:①中和法;②化学沉淀法;③氧化还原法;④过滤法。其中属于化学方法的有 A.①②③ B.①②④ C.②③④ D.①②③④ 2、景德镇在清代后期仿制“均红”瓷釉,配方中含有少量铅、锡和硼,这里的铅、锡、硼是指 A、分子 B、原子 C、单质 D、元素 3、小明到医院检查身体后,医生建议他多吃水果和蔬菜,请你判断医生让他主要补充的是 A维生素 B蛋白质 C 油脂 D 糖类 4、电子工业制造光电管时,需要一种经强光照射就失去电子,从而接通电路的材料。根据金属的性质可推断该金属在金属活动顺序表中位置 A.在Pb和H之间 B.在K前面 C.在H后 D.在Cu后 5、2008年北京奥运吉祥物福娃的外材为纯羊毛线,内充物为聚脂纤维。下列对羊毛线和聚脂纤维和说法不正确的是 A.这种“福娃”不宜用碱性强的洗涤剂清洗 B.可用灼烧法区分羊毛线和聚脂纤维 C.聚酯纤维是天然材料 D.羊毛线的主要成分是纤维素 6、将质量相等的A、B、C三种金属,同时分别放入三份溶质质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示。根据图中所提供的信息,得出的结论正确的是。(已知:A、B、C在生成物中均为+2价)  A.反应速率最大的是A A.反应速率最大的是AB.放出H2的质量是A>B>C C.金属活动性顺序是A>B>C D.相对原子质量是C>B>A 7、所谓合金,就是不同种金属(或金属与非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点判断,其中不能形成合金的是
A.Cu和Al B.Fe和Cu C.Fe和Na D.Al和Na 8、下列生活经验正确的是 A.晚上回家发现家里煤气泄漏,立即开灯打“110”报警 B.家里冰箱有异味时,可以放一块木炭除臭 C.学校档案室失火后应用泡沫灭火器灭火 D.炒菜时油锅中着了火,用水浇熄 9、我们中华民族的祖先在世界冶金史上曾谱写过辉煌的篇章。早在距今2000余年前的西汉时期,就有“曾青得铁则化为铜”的记述,此乃现代湿法冶金术之先驱。从现代化学观点理解,“曾青”应赋予的最恰当涵义为 A.铜(单质)B.硫酸铜(溶液)C.铜的化合物D.可溶性铜盐(溶液) 10.下列实验方案中,可行的是 A.按溶解、过滤、蒸发的操作顺序可以分离CaCl2、CaCO3的混合物 B.向某种溶液中加入氯化钡溶液,产生白色沉淀,证明该溶液一定是硫酸 C.用磷在密闭容器中燃烧,除去密闭容器内空气中的氧气 D.用玻璃棒蘸取食用白醋滴在润湿pH试纸上,测定其pH 11、在配制质量分数为10%的氯化钠溶液的过程中,导致溶液中氯化钠质量分数小于10%的原因可能是 ① 用量筒量取水时俯视读数 ②配制溶液的烧杯用少量蒸馏水润洗 ③ 在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数 ④盛装溶液的试剂瓶用蒸馏水润洗 ⑤氯化钠晶体不纯 A. ①②③④⑤ B. ①②④⑤ C. ②③④⑤ D. ①②③ 12、在水溶液中,一般不会与其它物质发生复分解反应的是 A.NaCl B.KNO3 C.NaOH D.H2SO4 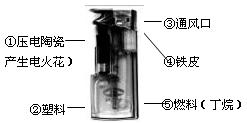 13、打火机给人们生活带来方便,右图是普通电子打火机的实物照片。下面可以做到符合 13、打火机给人们生活带来方便,右图是普通电子打火机的实物照片。下面可以做到符合燃烧条件能打火的组合是 A.①③⑤ B.①③④ C.①②③ D.①②④ 14、小芳做探究性实验:用称量法测定铁在O2燃烧的产物。发现5.6g铁在足量的O2中燃烧得到7.82g固体。小芳排除了其他因素可能产生的误差,则她得到的固体产物可能是( ) A.Fe3O4和Fe的混合物 B.Fe3O4和FeO的混合物 C.Fe3O4和Fe2O3的混合物 D、 Fe3O4、FeO和Fe的混合物 15、在AgNO3、Mg(NO3)2和Cu(NO3)2的混合溶液中,加入一定量的铁粉充分反应后,过滤,洗涤,将滤渣放入盐酸中有气泡产生,滤液中存在的阳离子是( ) A.Cu2+ B 只有Fe3+ C Fe2+ D Mg2+
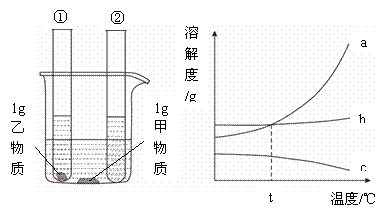
二、填空题(本大题包括8小题,共34) 16、(3分)日常生活中,家用热水瓶内胆壁上的金属是 ;玻璃刀刀头是用 制成的;发酵粉的主要成份是 ; 17、(2分)中央电视台《《幸运52》节目中有一道这样的题目,根据左边提示猜测这是何种物质,请你在右边的横线上写出其化学式。 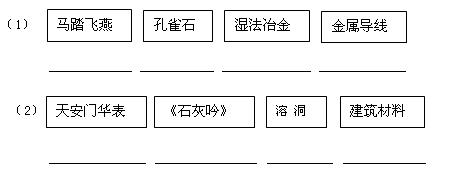 18、(5分)某自来水厂用源水处理成自来水的流程如下: 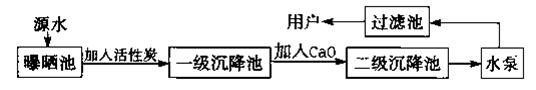 (1)加入活性炭的作用是 ;在乡村没有活性炭,常加入 来净水。 (2)实验室中,静置、吸附、过滤、蒸馏等操作中可以降低水硬度的是 。 (3)若该地区源水中含有较多的MgCl2,请写出在源水处理流程中加入CaO时有关化学方程式: ① ; ② 。 19、(6分)镁在空气中燃烧生成氧化镁和氮化镁(其中氮为-3价),氮化镁与水反应生成氢氧化镁和氨气。 (1)写出氮化镁与水反应的化学方程式 ;; (2) 若有24g镁在空气中完全燃烧,则所得产物的总质量与40g的关系是 。 (3)已知氮化镁是一种黄绿色的固体。根据镁在空气中燃烧的实验现象,可知在这样的条件下,镁更易与空气中的 化合,理由是 。 (4)镁条还能在二氧化碳中燃烧,生成一种白色固体和一种黑色固体,请写出该反应的的 该化学反应的基本类型 。 20、(7分)阅读材料,回答问题: 材料1.臭氧是淡蓝色气体,大气中的臭氧层能有效阻挡紫外线,保护地球的生存环境,但目前南极出现了臭氧层空洞,并有继续扩大的趋势。 材料2.复印机在工作时,会因高压放电产生一定浓度的臭氧。长期吸入大量臭氧会引 起口干舌燥,咳嗽等不适症状,还可能诱发中毒性肺气肿。 材料3.臭氧发生器是在高压电极的作用下将空气中的氧气转化为臭氧(化学式为O3)的装置。利用臭氧的强氧化性,可将其应用于游泳池、生活用水、污水的杀菌和消毒。 (1)请总结臭氧的有关知识:①物理性质: ; ②化学性质: ;③用途: ; (2)请从分子构成的角度,指出氧气和臭氧的不同点: ; (3)写出材料3中氧气转化为臭氧的化学方程式: ; (4)磷在臭氧中燃烧与在氧气中燃烧相似,请写出磷在臭氧中燃烧的化学方程式: ; (5)从上述材料中可见臭氧对人类有利有弊。请再举出一种物质,并说出其利弊: ; 21.(6分)如图所示,在室温情况下,烧杯中盛装的是甲物质的溶液,试管①中盛装的是乙物质的溶液,试管②中盛装的是丙物质的溶液。当它们由室温升到80℃时,发现烧杯中甲物质没有明显变化,而试管①中盛装的是乙物质全部溶解,试管②中有丙物质析出。请你据此现象回答下列有关问题:
(1)室温时,___________(选填“烧杯”、“试管①”或“试管②”)中溶液可能是不饱和溶液; (2)上图能表示甲物质的溶解度曲线的是__________(选填“a”、“b”或“c”,下同),能表示丙物质的溶解度曲线的是____________; (3)若乙物质溶液中混有少量的甲物质,可采取的提纯方法是_______________(选填“降温结晶”、“蒸发结晶”); (4)若将试管①从烧杯中取出冷却至室温后,从溶液中析出的固体质量为__________g; (5)在温度_________时,乙物质的饱和溶液一定比甲物质的饱和溶液溶质质量分数更大。 部分物质的溶解性表(20℃)
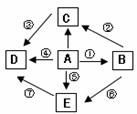 22、(5分)如图A、B、C、D、E是初中化学中常见的五种物质,且它们都含有一种相同的元素。其中D为食盐的主要成分,B、E的溶液都有颜色,其它物质溶液均为无色。转变⑥为置换反应,其它各转变均为复分解反应(部分物质的溶解性见右表)。根据图示关系及所给条件完成下列各空:(1)写出下列物质的化学式A________ ,D_________; 22、(5分)如图A、B、C、D、E是初中化学中常见的五种物质,且它们都含有一种相同的元素。其中D为食盐的主要成分,B、E的溶液都有颜色,其它物质溶液均为无色。转变⑥为置换反应,其它各转变均为复分解反应(部分物质的溶解性见右表)。根据图示关系及所给条件完成下列各空:(1)写出下列物质的化学式A________ ,D_________;(2)C属于______(填“酸”、“碱”、“盐”或“氧化物”)类物质; (3写出实现下列各转变的化学方程式: ③ ,⑥ _。
三、实验题(本大题包括3小题,共22分) 23、(5分)为了探究氨气(NH3)的某些性质,某同学做了以下实验: 下图中从左向右依次是他做的实验及相应现象。 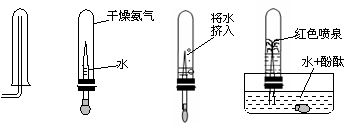 A B C D (1)通过实验,小明同学可得出氨气的三点性质,分别是:① ;② ;③ ; (2)A操作中,导气管要尽量接近试管底部,其目的是 。 (3)下列物质中可以用于干燥氨气的是( ) a.浓硫酸 b .生石灰 c .五氧化二磷 24.(6分)为了测定水的组成选用下列装置回答问题:(氢气用盐酸和锌制得)  (1)为准确测定水的组成,为防止杂质干扰,正确的连接顺序为:己 (2)乙装置的作用是 ______ _______ 。 (3)若测得丁装置中样品在实验前后减少6.4 g,乙装置中药品增加了7.2 g,丙装置增加了3.6 g,根据此可求出水中H、O质量比为(只写计算式)______________ 。 (4)实验结束后,若丁处仍有黑色固体,这对实验的结果的影响是_______(填“氧的质量偏大”、“氢的质量偏大”、“无影响” ); (5)装置中的丙能否省去? 为什么? 。 25、(11分)“嫦娥一号”飞船的成功发射是我国航天事业的又一里程碑。金属过氧化物等可作宇宙飞船或潜水艇中的氧气再生剂,如:过氧化钠(Na2O2)在常温下能与人呼出的二氧化碳反应生成氧气,化学方程式为:2Na2O2+2CO2===2Na2CO3+O2;(过氧化钠还能与盐酸、水等物质发生反应产生氧气)为了验证该反应中氧气的产生,某兴趣小组的同学设计了如右图所示的实验。 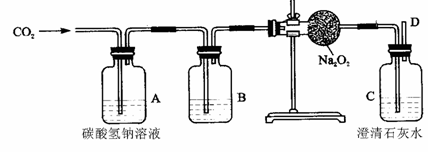 (1)实验室确定气体发生装置时应考虑的因素是 ; 制取CO2的装置,应从下列图1、图2、图3中选择 。 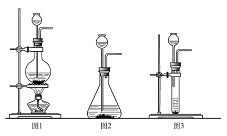 (2)检查图2装置的气密性的方法是:将装置中导气管上的胶皮管用弹簧夹夹住,往长颈漏斗中注入水至液面高出漏斗颈的下端管口,若能观察到 现象,即可证明装置不漏气。 (3)设计A、B装置的目的是净化导入的纯净且干燥的CO2 。其中,①A装置的具体功能是________________所发生的化学方程式是___________________________________; ②B装置的具体功能是_______________,其瓶内液体应是___________ ; (4)为了确定CO2跟Na2O2反应产生的气体是氧气,最后还要采用的验证实验操作是____________________________________________________________________。 (5)表明二氧化碳没有被过氧化钠完全吸收的现象是 。 (6)常温下水也能与Na2O2反应,生成氧气和氢氧化钠,写出该反应的化学方程式。 ; (7)某潜水艇上有4人,如果每人每小时消耗的氧气在某温度和压强条件下体积为50L,则该潜水艇中每天需要过氧化钠多少千 g?(已知:在上述温度和压强条件下氧气的密度为1.5g/L) 。
四、计算题(本大题包括2小题,共14分) 26.(6分)钢铁工业是国家工业的基础。2006年我国粗钢产量突破4亿吨,居世界首位。某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识。请您对社会实践活动小组感兴趣的问题进行计算: (1)将6.72 g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH 溶液,充分反应后,过滤、洗涤、灼烧得4.80 g Fe2O3。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00 t生铁(含铁96%),至少需要这种铁矿石多少吨? (保留两位小数) 27、(8分)某班同学完成制取二氧化碳的实验后,对回收的盐酸和氯化钙混合溶液(不考虑其他杂质)进行了以下实验:取40 mL该溶液于烧杯中,滴入40 g溶质质量分数为13.8%的K2CO3溶液。滴入K2CO3溶液质量与生成沉淀质量的关系如右图所示。求:  (1)所取40 mL溶液中HCl和CaCl2的质量。 (1)所取40 mL溶液中HCl和CaCl2的质量。(2)实验结束后,若将烧杯中的物质蒸干, 得到固体的质量。 K2CO3溶液质量/g 2008年江西省初中学生化学素质和实验能力竞赛初赛试题参考答案 一、选择题
二、填空题 16、(3分)银(Ag) 金刚石(C) 碳酸氢钠(NaHCO3 ) 17、(2分) Cu、Ca CO3 18、(5分) (1)吸附杂质 明矾 (2)蒸馏 (3)CaO+H2O=Ca(OH)2 Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2 19、(6分)(1)Mg3N2+6H2O==3Mg(OH)2↓+2NH3↑; (2.) < (3) O2;生成物基本上是白色的,说明产物中MgO较多,而Mg3N2较少。 (4)2Mg + CO2 = 2MgO + C 置换反应 20、(7分) :(1) ①淡蓝色气体 ; ②具有强氧化性 ;③ 用于游泳池、生活用水、污水的杀菌和消毒 ; (2) 构成它们各自分子的氧原子的个数不同 ; (3) 3O2 (4) 6P + 5O3 =点燃 3P2O5 (5) CO2 可用于灭火但过多排放会造成温室效应 ; 21、(6分)(1)试管②;(2)b c;(3)降温结晶;(4)1;(5)大于t℃ 22.(5分) (1)HCl ,NaCl ;(2) 盐;(3 )③Na2CO3+BaCl2==BaCO3↓+2NaCl等 ⑥ Fe+CuCl2=Cu+FeCl2 三、实验题 23、(5分) (1)氨气(极)易溶于水 ;氨气的密度比空气小; 氨气会和水发生化学反应,反应后的溶液显碱性 (2)使收集到的气体更纯 (3)b 24、(6分) (1)己—甲—戊---丁----乙---丙,(2)吸收氢气还原氧化铜后生成的水 (3)(7.2-6.4):6.4 (4)无影响 (5)不能; 它的目的是吸收空气中的水蒸气,否则会影响实验的结果。 25.(11分) (1) 反应物的状态和反应条件等 图2 (2) 漏斗颈中形成一段稳定的水柱(或液面不再下降)等 (3) ①吸收二氧化碳中混有的氯化氢气体 NaHCO3+HCl==NaCl+H2O+CO2↑ ②干燥二氧化碳 浓硫酸 (4)将带火星的木条放在集气瓶上方的导管口附近 (5)C装置处的澄清石灰水变浑浊 (6)2Na2O2+2H2O===4NaOH+O2↑ (7)35.1kg。 四、计算题 26.(6分) (1)6.72 g铁矿石中铁的质量为m(Fe) = 4.80 g× 有: 矿石 ~ 生铁 27.(8分) 解:设40 mL溶液中所含HCl和CaCl2的质量分别为x、y, K2CO3与HCl反应生成KCl的质量为m,K2CO3与CaCl2反应生成KCl的质量为n。 K2CO3 + 2HCl === 2KCl + H2O + CO2↑ 138 73 149 10 g×13.8% x m K2CO3 + CaCl2 === CaCO3↓ + 2KCl 111 100 149 y 2 g n 剩余K2CO3的质量为10 g×13.8%=1.38 g ------------(2分) 固体的质量为1.49 g+2.98 g+1.38 g + 2 g=7.85 g≈7.9 g -----(2分) 答:40 mL溶液中所含HCl和CaCl2的质量分别为0.7 g、2.2 g,得到固体的质量为7.9 g。 (责任编辑:admin) |