一、溶液的形成
1、溶液
(1)溶液的概念:一种或几种物质分散到另一种物质里形成的均一的、稳定的混合物,叫做溶液
(2)溶液的基本特征:均一性、稳定性的混合物
注意:
a、溶液不一定无色,如CuSO4为蓝色 FeSO4为浅绿色 Fe2(SO4)3为黄色
b、溶质可以是固体、液体或气体;水是最常用的溶剂
c、溶液的质量 = 溶质的质量 + 溶剂的质量
溶液的体积 ≠ 溶质的体积 + 溶剂的体积
d、溶液的名称:溶质的溶剂溶液(如:碘酒——碘的酒精溶液)

3、饱和溶液、不饱和溶液
(1)概念:
(2)判断方法:看有无不溶物或继续加入该溶质,看能否溶解
(3)饱和溶液和不饱和溶液之间的转化

注:①Ca(OH)2和气体等除外,它的溶解度随温度升高而降低
②最可靠的方法是:加溶质、蒸发溶剂
(4)浓、稀溶液与饱和不饱和溶液之间的关系
①饱和溶液不一定是浓溶液
②不饱和溶液不一定是稀溶液,如饱和的石灰水溶液就是稀溶液
③在一定温度时,同一种溶质的饱和溶液一定要比它的不饱和溶液浓
(5)溶解时放热、吸热现象
溶解吸热:如NH4NO3溶解
溶解放热:如NaOH溶解、浓H2SO4溶解
溶解没有明显热现象:如NaCl
二、溶解度
1、固体的溶解度
(1)溶解度定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量
四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:单位:克
(2)溶解度的含义:
20℃时NaCl的溶液度为36g含义:
在20℃时,在100克水中最多能溶解36克NaCl
或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克
(3)影响固体溶解度的因素:①溶质、溶剂的性质(种类) ②温度
a.大多数固体物的溶解度随温度升高而升高;如KNO3
b.少数固体物质的溶解度受温度的影响很小;如NaCl
c.极少数物质溶解度随温度升高而降低。如Ca(OH)2
(4)溶解度曲线
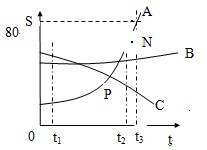
(1)t3℃时A的溶解度为 80g
(2)P点的的含义在该温度时,A和C的溶解度相同
(3)N点为 t3℃时A的不饱和溶液 ,可通过加入A物质,降温, 蒸发溶剂的方法使它变为饱和
(4)t1℃时A、B、C、溶解度由大到小的顺序C>B>A
(5)从A溶液中获取A晶体可用降温结晶的方法获取晶体。
(6)从A溶解度是 80g .
(7)t2℃ 时A、B、C的饱和溶液各W克,降温到t1℃
会析出晶体的有A和B 无晶体析出的有 C ,所得溶液中溶质的质量分数由小到大依次为 A<C<B
(8)除去A中的泥沙用过滤 法;分离A与B(含量少)的混合物,用结晶法
2、气体的溶解度
(1)气体溶解度的定义:在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。
(2)影响因素: ①气体的性质 ②温度(温度越高,气体溶解度越小)
③压强(压强越大,气体溶解度越大)
3、混合物的分离
(1)过滤法:分离可溶物 + 难溶物
(2)结晶法:分离几种可溶性物质
结晶的两种方法
a.蒸发溶剂,如NaCl(海水晒盐)
b.降低温度(冷却热的饱和溶液,如KNO3)
三、溶质的质量分数
1、公式:

2、在饱和溶液中:
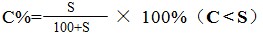
3、配制一定溶质质量分数的溶液
(1)用固体配制:
①步骤:计算、称量、溶解
②仪器:天平、药匙、量筒、滴管、烧杯、玻璃棒
(2)用浓溶液稀释(稀释前后,溶质的质量不变)
①步骤:计算、量取、稀释
②仪器:量筒、滴管、烧杯、玻璃棒
(责任编辑:admin) |