九年级化学上册|碳和碳的氧化物知识点梳理
http://www.newdu.com 2025/11/05 09:11:11 三好网 佚名 参加讨论
同学们开始进入初中阶段最后一年的学习了,相对于前几年的学习,初三就略显紧张,考入一所好的高中,等于早一步踏入了一所好的大学之门。为此,小编为大家整理了九年级数学上册,碳和碳的氧化物知识点梳理,方便同学们暑期预习,一起来学习吧!  碳和碳的氧化物 一、碳的几种单质 1、金刚石(C)是自然界中最硬的物质,可用于制钻石、刻划玻璃、钻探机的钻头等。 2、石墨(C)是最软的矿物之一,有优良的导电性,润滑性。可用于制铅笔芯、干电池的电极、电车的滑块等。注意:铅笔里面其实不含铅,是石墨和黏土混合而成的混合物。H代表Hard,坚硬的;B代表Black,黑的。6B最软,颜色最深;6H最硬,HB软硬适中。 3、无定形碳:由石墨的微小晶体和少量杂质构成.主要有:焦炭,木炭,活性炭,炭黑等. 活性炭、木炭具有强烈的吸附性,但活性炭的吸附作用比木炭要强,如制糖工业利用其来脱色,防毒面具里的滤毒罐也是利用活性炭来吸附毒气。焦炭用于冶铁,炭黑加到橡胶里能够增加轮胎的耐磨性。 4、C60是一种由60个碳原子构成的分子,形似足球,性质很稳定。 5、金刚石和石墨的物理性质有很大差异的原因是:碳原子的排列不同。 CO和CO2的化学性质有很大差异的原因是:分子的构成不同。 二、.单质碳的化学性质: 单质碳的物理性质各异,而各种单质碳的化学性质却完全相同! 1、常温下的化学性质稳定【为何碳在常温下化学性质比较稳定?碳原子的最外层有4个电子,既不容易得电子,也不容易失去电子,因此常温下碳的化学性质比较稳定。档案材料一般用碳素墨水书写、古代书画历经百年也安然无恙、木质电线杆埋入地下部分用火烧焦可防腐都是利用这个原理。】 2、可燃性: 完全燃烧(氧气充足),生成CO2: C+O2点燃CO2 不完全燃烧(氧气不充足),生成CO:2C+O2点燃2CO 3、还原性:C+2CuO 高温 2Cu+CO2↑ (置换反应) 应用:冶金工业 现象:黑色粉末逐渐变成光亮红色,澄清的石灰水变浑浊。 111 三、二氧化碳的制法 1、实验室制取气体的思路:(原理、装置、检验) (1)发生装置:由反应物状态及反应条件决定: 反应物是固体,需加热,制气体时则用高锰酸钾制O2的发生装置。 反应物是固体与液体或液体与液体,不需要加热,制气体时则用制H2的发生装置。 (2)收集方法:气体的密度及溶解性决定: 难溶于水用排水法收集 CO只能用排水法(排空气法易中毒) 密度比空气大用向上排空气法 CO2只能用向上排空气法(它能溶于水且与水反应) 密度比空气小用向下排空气法 2、二氧化碳的实验室制法 1)原理:用石灰石和稀盐酸反应:CaCO3+2HCl==CaCl2+H2O+CO2↑ 2) 选用和过氧化氢制氧气(制氢气)相同的发生装置 3)气体收集方法:向上排空气法 4)验证方法:将制得的气体通入澄清的石灰水,如能浑浊,则是二氧化碳。 验满方法:用点燃的木条,放在集气瓶口,木条熄灭。证明已集满二氧化碳气体。 3、二氧化碳的工业制法: 煅烧石灰石:CaCO3高温CaO+CO2↑ 【生石灰和水反应可得熟石灰:CaO+H2O=Ca(OH)2】 5、实验室制取二氧化碳步骤 一检、二装、三注入、四收集 6、正确制取二氧化碳的装置图 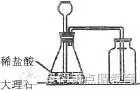 错误制取二氧化碳的装置图 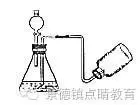 7、制取二氧化碳的注意事项 四、二氧化碳的性质 1、物理性质:无色,无味的气体,密度比空气大,能溶于水,高压低温下可得固体----干冰 2、化学性质: 1)一般情况下不能燃烧,也不支持燃烧,不能供给呼吸 2)与水反应生成碳酸: CO2+H2O==H2CO3 生成的碳酸能使紫色的石蕊试液变红,H2CO3 == H2O+ CO2↑ 碳酸不稳定,易分解 3)能使澄清的石灰水变浑浊:CO2+Ca(OH)2==CaCO3↓+H2O 本反应可用于检验二氧化碳。 4)与灼热的碳反应: C+CO2高温2CO (吸热反应,CO2是氧化剂,C是还原剂) 3、用途:灭火(灭火器原理:Na2CO3+2HCl==2NaCl+H2O+CO2↑) 既利用其物理性质,又利用其化学性质。干冰用于人工降雨、制冷剂利用其物理性质。 温室肥料 4、危害及防治措施 温室效应——原因:过多的CO2、O3、CH4、氟氯代烷等 1、减少使用煤、石油、天然气等化石燃料 2、开发新能源如、太阳能、风能、地热等清洁能源。 3、大力植树造林、严禁乱砍滥伐森林。 五、一氧化碳的性质 1、物理性质:无色,无味的气体,密度比空气略小,难溶于水 2、化学性质: (H2、CO、C具有相似的化学性质:①可燃性 ②还原性) 1)可燃性:2CO+O2点燃2CO2 (可燃性气体点燃前一定要检验纯度) 【H2和O2的燃烧火焰是:发出淡蓝色的火焰;CO和O2的燃烧火焰是:发出蓝色的火焰;CH4和O2的燃烧火焰是:发出明亮的蓝色火焰。】 2)还原性: CO+CuO △ Cu+CO2 【非置换反应】 应用:冶金工业 现象:黑色的氧化铜逐渐变成光亮红色,石灰水变浑浊。 记住要领:一氧化碳早出晚归,酒精灯迟到早退。 尾部酒精灯的作用是处理尾气,防止一氧化碳污染空气。 3)有毒:吸进肺里与血液中的血红蛋白结合,使人体缺少氧气而中毒。 第七单元 燃烧及其利用 一、燃烧和灭火 1、燃烧的条件:(缺一不可) (1)可燃物 (2)氧气(或空气) (3)温度达到着火点 2、灭火的原理:(只要消除燃烧条件的任意一个即可) (1)消除可燃物 (2)隔绝氧气(或空气) (3)降温到着火点以下 3、影响燃烧现象的因素:可燃物的性质、氧气的浓度、与氧气的接触面积 使燃料充分燃烧的两个条件:(1)要有足够多的空气 (2)燃料与空气有足够大的接触面积。 4、爆炸:可燃物在有限的空间内急速燃烧,气体体积迅速膨胀而引起爆炸。 一切可燃性气体、可燃性液体的蒸气、可燃性粉尘与空气(或氧气)的混合物遇火种均有可能发生爆炸。 二、燃料和能量 1、三大化石燃料:煤、石油、天然气(混合物、均为不可再生能源) (1)煤:“工业的粮食”(主要含碳元素); 煤燃烧排放的污染物:SO2、NO2(引起酸雨) 、CO、烟尘等 (2)石油:“工业的血液”(主要含碳、氢元素); 汽车尾气中污染物:CO、未燃烧的碳氢化合物、氮的氧化物、含铅化合物和烟尘 (3)天然气是气体矿物燃料(主要成分:甲烷),是较清洁的能源。 2、两种绿色能源:沼气、乙醇 (1)沼气的主要成分:甲烷 甲烷的化学式:CH4 (最简单的有机物,相对分子质量最小的有机物) 物理性质:无色,无味的气体,密度比空气小,极难溶于水。 化学性质: 可燃性 CH4+2O2点燃CO2+2H2O(发出蓝色火焰) (2)乙醇 (俗称:酒精, 化学式:C2H5OH) 化学性质: 可燃性 C2H5OH+ 3O2点燃2CO2+3H2O 工业酒精中常含有有毒的甲醇CH3OH,故不能用工业酒精配制酒! 乙醇汽油:优点(1)节约石油资源 (2)减少汽车尾气 (3)促进农业发展 (4)乙醇可以再生 3、化学反应中的能量变化 (1) 放热反应:如所有的燃烧 (2) 吸热反应:如一般条件为“高温”的反应 4、新能源:氢能源、太阳能、核能、风能、地热能、潮汐能 氢气是最理想的燃料: (1)优点:资源丰富,放热量多,无污染。 (2)需解决问题:①如何大量廉价的制取氢气? ② 如何安全地运输、贮存氢气 化学方程式总结 一、物质与氧气的反应: 1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO 2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4 3. 铜在空气中受热:2Cu + O2 加热 2CuO 4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3 5. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O 6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O5 7. 硫粉在空气中燃烧: S + O2 点燃 SO2 8. 碳在氧气中充分燃烧:C + O2 点燃 CO2 9. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO 10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2 11. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O 12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O 二.分解反应: 13. 水在直流电的作用下分解:2H2O 通电 2H2↑+ O2 ↑ 14. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑ 15. 加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑ 16. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑ 17. 高温煅烧石灰石:CaCO3 高温 CaO + CO2↑ 三.氧化还原反应: 19. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O 20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑ 21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑ 22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温 3Fe + 2CO2↑ 23. 一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2 24. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2 25. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2 四、其他反应 26 实验室制CO2大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑ 27. CO2与水反应:H2O + CO2 === H2CO3 28 检验二氧化碳的方法:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O 29. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑ 元素符号及化学式: 元素符号: 气态非金属元素: 氧 O 氢 H 氯 Cl 氮 N 氟 F 固态非金属元素: 碳 C 硅 Si 硫 S 磷 P 碘 I 金属元素:钙 Ca 铁 Fe 钾 K 钠 Na 镁 Mg 铝 Cl 铜 Cu 锌 Zn 锰 Mn银 Ag 汞 Hg 钡 Ba 金 Au 铂 Pt 稀有气体元素:氦 He 氖 Ne 氩 Ar 原子团:硫酸根 SO4 碳酸根 CO3 氢氧根 OH 硝酸根 NO3 铵根 NH4 离子:硫酸根离子SO42- 碳酸根 CO32- 氢氧根 OH - 硝酸根 NO3- 铵根 NH4+ 物质的化学符号: 单质:氧气 O2 氢气 H2 氯气 Cl2 氮气 N2 臭氧 O3 硫磺 S 木炭 C 铁 Fe 氧化物:二氧化硫 SO2 二氧化氮 NO2 一氧化碳 CO 二氧化碳 CO2 氧化镁 MgO 四氧化三铁 Fe3O4 二氧化锰 MnO2 过氧化氢 H2O2 五氧化二磷 P2O5 氧化铜 CuO 三氧化二铝 Al2O3 化合物:氯酸钾 KclO3 氯化钾 KCl 锰酸钾 K2MnO4 硫酸锌 ZnSO4 硫酸 H2SO4 硫酸镁 MgSO4 氢氧化钙 Ca(OH)2 硫酸铜CuSO4 碳酸钙 CaCO3 碳酸 H2CO3 盐酸 HCl 高锰酸钾 KMnO4 酒精C2H5OH 甲烷CH4 氯化钙 CaCl2 (责任编辑:admin) |