|
初中化学,考点1 常见酸的主要性质和用途,认识酸的腐蚀性。 小编说:“酸类物质具有一些相似的化学性质是因为它们溶于水后产生的阳离子全部都是氢离子(H+)。” 一、盐酸、硫酸的性质比较 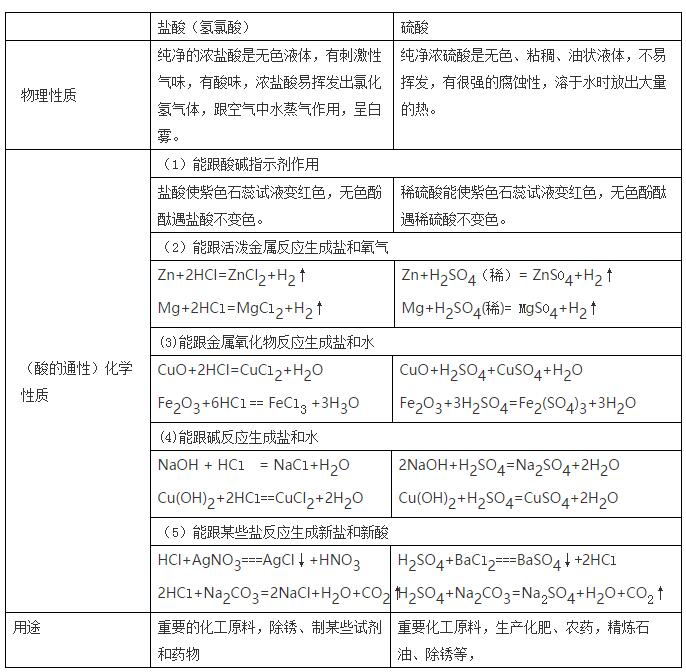 浓盐酸、浓硫酸、浓硝酸的特性 (1)浓盐酸:具有挥发性,在空气中易形成白雾。 (2)浓硫酸:具有吸水性(可作为干燥剂);脱水性(化学变化,使有机物碳化);强氧化性(与金属反应不生成氢气)。 (3)浓硝酸:具有挥发性,在空气中易形成白雾,强氧化性,与金属反应不生成氢气而生成水。 考点2 常见碱的主要性质和用途,认识碱的腐蚀性。 碱类物质具有一些相似的化学性质是因为它们溶液中存在的阴离子全部都是氢氧根离子(OH-)。 1、氢氧化钠特性 氢氧化钠固体暴露在空气易吸收空气中的水蒸气而潮解,因此可作某些气体的干燥剂。同时还吸收空气中的二氧化碳而变质,所以氢氧化钠必须密封保存。 2、相关干燥剂的选择 原则:干燥剂与被干燥的气体不发生化学反应。如浓H2SO4可干燥O2、H2、CO2、SO2、HCl等气体,但不能干燥NH3(碱性气体);NaOH固体可干燥O2、H2、NH3等气体,但不能干燥CO2、SO2、HCl等酸性气 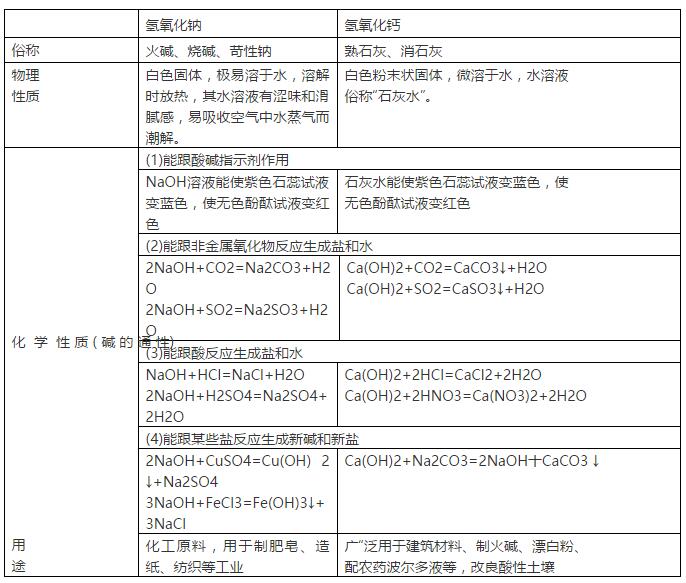 考点3 会用酸碱指示剂和pH试纸检验溶液的酸碱度。 1.酸碱指示剂:能跟酸或碱的溶液作用而显示不同颜色的物质,如石蕊和酚酞试液。 2.pH—表示溶液酸碱性的强弱程度。 数值0—14之间。最简单的测试溶液pH的方法是使用pH试纸:将一小块pH试纸放在玻璃片上,用玻璃棒蘸取待测液滴在pH试纸上,将pH试纸显示的颜色和标准比色卡比较,得出溶液的pH值。 3.溶液的酸碱度 ⑴ pH 溶液的酸碱度常用pH来表示。pH的范围通常在_0----14_之间。 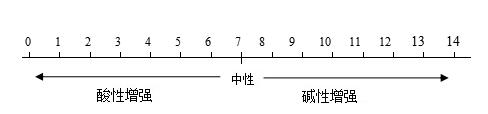 ⑵ 改变溶液pH 的方法: ①使溶液的pH 增大要加入碱溶液或金属氧化物或是水; ②使溶液的pH 减小要加入酸溶液或水。 4.溶液酸碱性对生命活动和农作物生长的影响。 (1)中和反应:酸和碱作用生成盐和水的反应叫做中和反应。 (2)测定人体内或排出的液体的pH,可以了解人体的健康状况。 (3)许多化工生产需在一定的酸碱性的溶液中进行。 (4)测定雨水的酸碱性可以了解空气的污染情况。 (5)农作物一般在中性或接近中性的土壤中生长 声明: (责任编辑:admin) |
