|
《溶解度》同步测试(第1课时) 北方交大附中 周 丽 一、选择题(每小题只有一个选项符合题意) 1.一定温度下,向某物质的饱和溶液中,加入一些该溶质的固体, 则下列说法正确的是( ) A.溶质质量减少 B.溶液质量增大 C.固体质量不变 D.溶质质量增加. 考查目的:对饱和溶液概念的准确理解和把握;溶质、溶剂、溶液的关系。 答案:C 解析:理解饱和溶液概念要注意四个关键“一定温度”、“一定量溶剂”、“溶质不能继续溶解”、“这种溶质”的饱和溶液。本题主要考查饱和溶液中该溶质不能继续溶解,因此,固体的质量不变,溶液中溶质的质量不变,溶剂的质量不变,所以溶液的质量也不变。故C项正确。 2.能证明20℃时某一硝酸钾溶液已达到饱和的方法是 ( ) A.向20℃时该溶液中加入少量水,溶液变稀 B.向该溶液里加入少量硝酸钾固体,搅拌、过滤并称量,固体的质量不变 C.取少量溶液降温,有固体析出 D.取少量溶液升高温度,无固体析出 考查目的:饱和溶液的判断方法。 答案:B。 解析:只有指明“在一定量的溶剂里”和“一定温度下”,溶液的饱和才有确定的意义。因为改变溶剂的量或改变温度,溶液的状态会改变,因此要判断溶液是否饱和,要在溶剂的量和溶液的温度不变的情况下,加入同种溶质,观察固体的质量是否减少,如果加入固体的质量减少了,说明原溶液不饱和;如果加入固体的质量不变,则说明原溶液是饱和溶液.故选项B正确。 3.饱和溶液用水稀释变成不饱和溶液的过程中,保持不变的是 ( ) A.溶质的质量 B.溶剂的质量 C.溶液的质量 D.溶质与溶剂的质量比 考查目的:溶质、溶剂、溶液的关系。 答案:A。 解析:饱和溶液用水稀释,溶剂的质量增加,由于溶液中未加入溶质,所以溶质的质量不变,溶质与溶剂的质量比也随之改变,溶液的总质量也改变。故选项A正确。 4.某密闭容器内的KNO3饱和溶液的温度由80 ℃降温到20 ℃,下列说法正确的是 ( ) A.溶质质量不变 B.溶液仍饱和 C.溶液质量不变 D.变成不饱和溶液 考查目的:结晶的概念;溶质、溶剂、溶液的关系。 答案:B 解析:硝酸钾在一定量水中溶解的最大限度随温度的升高而增大,因此,降低温度,溶剂水的量不变,硝酸钾的最大溶解量减小,析出晶体,A项错误;析出晶体后所得溶液为硝酸钾的饱和溶液,故B项正确,D项错误;溶液的质量=溶质的质量+溶剂的质量,所以当降低温度析出硝酸钾时,由于溶质的质量减少,溶剂的质量不变,而导致溶液的质量减少,故C错误。 5.下列有关饱和溶液的说法中,正确的是 ( ) A.饱和溶液降温析出晶体后的溶液一定是不饱和溶液 B.饱和澄清石灰水中加入少量生石灰后,恢复到原温度,则石灰水溶液的质量增大 C.一定温度下,向饱和食盐水中加入白糖,白糖不会溶解 D.一定温度下,向氯化钠饱和溶液中加入水后会变成不饱和溶液 考查目的:饱和溶液的概念,溶液、溶剂、溶质的关系,生石灰的性质。 答案:D 解析:溶液只有达到饱和后才能析出晶体,所以析出晶体后的溶液一定是该溶质的饱和溶液,故A项错误;饱和的澄清石灰水中加入少量的生石灰,生石灰是CaO,CaO+H2O=Ca(OH)2,溶剂水减少,所能溶解的Ca(OH)2质量减少,所以石灰水溶液的质量减少,故B项错误;饱和溶液是指一定温度下,一定量溶剂里,不能再溶解该溶质的溶液,对于其他固体还可以溶解,故C项错误;一定温度下,饱和溶液中加入水后一定会变成不饱和溶液,故D项正确。 6.(2011年滨州市)下列关于海水晒盐原理的分析正确的是 ( ) A.利用阳光照射,使海水升温得到食盐 B.利用海风降温析出食盐晶体 C.利用海水在阳光下发生分解反应制得食盐 D.利用阳光和风力使水分蒸发得到食盐 考查目的:海水晒盐的原理和过程。 答案:D 解析:了解常见的结晶方法,是解题的关键.用海水晒盐,是把海水引入海滩,借助日光和风力使水分蒸发,从而得到食盐晶体.故D项正确.海水是混合物,食盐从中析出不是化学变化,不是分解反应,所以C错。 7.在温度不变时,某物质的溶液m1经过如下变化:下列结论不正确的是 ( )。  A.m1溶液一定是不饱和溶液 B. m2溶液不一定是饱和溶液 C.m3溶液一定是饱和溶液 D.将m3溶液再蒸发5g水,析出晶体一定是2g 考查目的:饱和溶液的判断方法,结晶的概念。 答案:D。 解析:对某溶液来说,蒸发溶剂后无固体析出,得到的溶液可能是不饱和溶液,也可能恰好达到饱和,但对饱和溶液来说,蒸发溶剂后,由于溶剂减少一定会有溶质析出;所以A、B、C项均正确;m2溶液析出晶体后得到的m3溶液一定是饱和溶液,若m2溶液恰好是饱和溶液时,蒸发5g水析出2g晶体,m3溶液再蒸发5g水,析出的晶体也是2g,若m2溶液是不饱和溶液时,蒸发5g水析出2g晶体,m3溶液再蒸发5g水,析出的晶体一定大于2g,故D错误; 8.向一瓶接近饱和的氯化铵溶液中,逐渐加入氯化铵晶体,下列图象符合溶液中溶质质量变化规律的是 ( ) 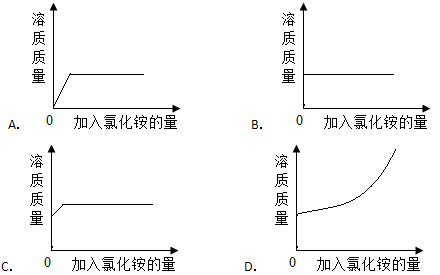 考查目的:不饱和溶液转变为饱和溶液的过程中溶质的质量的变化,图像分析.。 答案:C。 解析:解图像题关键看三方面:一看“面”,即图像的横纵坐标,二看“线”,即图线的走向,三看“点”。即图线的起点、拐点、终点。不饱和氯化铵溶液中含有一定量的溶质氯化铵,所以加入氯化铵之前,不饱和的氯化铵溶液中溶质的质量不为0,故A项错误;向一定量不饱和氯化铵溶液中逐渐加入氯化铵固体时,氯化铵能够继续溶解,溶质质量增加,直到达到饱和状态,而不是一直不变,故B项错误;在一定温度下,在一定量的溶剂里,氯化铵不能无限溶解,D项错误,故C项正确. 9. 20℃时,往50克KNO3溶液中加入5gKNO3晶体,充分搅拌后部分晶体未溶解,稍加热后,晶体全部溶解,下列说法正确的是 ( ) A.搅拌后加热前一定是饱和溶液 B.搅拌后加热前一定是不饱和溶液 C.加热后一定是饱和溶液 D.加热后一定是不饱和溶液 考查目的:饱和溶液的判断方法。 答案:A。 解析:20℃时,往50g硝酸钾溶液中加入5g硝酸钾晶体,充分搅拌后,尚有部分晶体未溶,则搅拌后及加热前一定是饱和的,A项正确;B项不正确;稍加热后,晶体全部溶解,可能不饱和溶液、也可能饱和溶液,故C项、D项均不正确。 10.常温下,在两只各盛有100mL水的烧杯中,分别加入相同质量的甲、乙两种物质,使其充分溶解,结果如图所示.下列说法正确的是 ( )  A.甲溶液一定是不饱和溶液 B.乙溶液可能是饱和溶液 C.甲溶液加少量水一定变成不饱和溶液 D.乙溶液加入少量乙一定变成饱和溶液 考查目的:饱和溶液的判断方法,饱和溶液和不饱和溶液的转化。 答案:B。 解析:由图可知,甲溶液中有固体剩余,则甲溶液一定为饱和溶液,故A错误;乙溶液中无固体留下,可能是饱和溶液也可能是不饱和溶液,故B项正确;C项,甲溶液中加入少量的水可能还有部分甲未溶解,不一定变成不饱和溶液;同样乙溶液加入少量乙也可能还未达到饱和,故C项、D项均错误。 二、填空题 1.在一定温度下,将一瓶接近饱和的硝酸钾溶液变成硝酸钾的饱和溶液,可采取的方法有: 。 考查目的:饱和溶液和不饱和溶液间的转化。 答案:降低温度、增加硝酸钾、减少溶剂。 解析:硝酸铵在一定量水中的最大溶解量随温度升高而增大,故降低温度可使接近饱和的硝酸钾溶液达到饱和;加入硝酸钾、蒸发水都可使溶液达到饱和。 2. 20℃时,NaCl溶解于水的实验数据如下表。
(1)①②③④溶液中是饱和溶液是 , (2)20℃时10g水最多能溶解氯化钠的质量是 , (3)①②③④溶液中溶质的质量相等的是 。 考查目的:对饱和溶液概念的准确理解和把握,溶质、溶剂、溶液的关系。 答案:(1)③④,(2)3.6g, (3) ③④。 解析:由第③次、第④次实验可知10g水,形成13.6g溶液,只溶解3.6g氯化钠,所以③④均有固体未溶解,则③④是饱和溶液,而第①次、第②次形成的溶液是不饱和溶液;根据溶液质量等于溶剂质量和溶质质量之和,所以第①次实验中溶质质量是2g,第②次实验中溶质质量是3g,第③次、第④次实验中溶质的质量是3.6g,所以③④溶液中溶质的质量相等。 3.A、B、C、D四个烧杯中分别盛有相等质量的水,在温度相同的条件下,向四个烧杯中分别加入20g、15g、10g、5g某物质(一定量水中该物质的最大溶解量随温度升高而增大),充分溶解后观察到如图所示的现象。请完成下列问题: ( ) 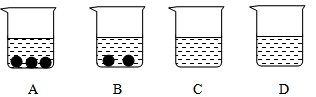 (1)在A、B、C、D四个烧杯中,____________中盛的一定是饱和溶液,____________中盛的可能是饱和溶液,____________中盛的一定不是饱和溶液。 (2)若固体是KNO3,对盛有一定是饱和溶液的烧杯加热,随着温度升高,先变成不饱和溶液的是____________。 (3)在一定温度下,往A、B中加入相同质量的水,B中固体刚好溶解,A中固体能否全部溶解?____________。 考查目的:对饱和溶液概念的准确理解和把握,饱和溶液和不饱和溶液的转化。 答案:(1)A、B;C;D (2)B (3) 不能。 解析:(1)A、B烧杯中有固体留下,可判断出A、B烧杯中溶液为饱和溶液,B、C、D中溶剂量相同,C烧杯中溶质比B烧杯中少,则C中可能是饱和溶液,也可能是不饱和溶液,而D 比C中溶质质量少,则D中溶液是一定是不饱和溶液。 (2)A、B中溶剂质量相同,而B比A剩余固体少,所以加热时B先变为不饱和溶液。 (3)A、B中溶剂质量相同,而B比A剩余固体少,往A、B中加入相同质量的水,B中固体刚好溶解,A中固体不能全部溶解。 (责任编辑:admin) |
