|
2018中考化学备考,2017年中考化学计算型压轴题解析。正所谓知己知彼,才能百战百胜。知道了中考化学中常考的四种计算型压轴题题型了,就要对症下药去多加练习,今天老师就带你一同来学习一下2017年各省市四种计算型压轴题。  一、根据化学方程式计算中的叙述题 1.(2017·呼和浩特)铁的氧化物有三种,分别是FeO、Fe2O3和Fe3O4。某固体粉未可能含有一种或两种铁的氧化物。取23.2克固体粉未,向其中通入足量一氧化碳并加热(假设固体完全反应),将反应生成的气体通入足量的澄清石灰水中。生成40.0克沉淀。试计算: (l)反应生成二氧化碳的质量为多少克?(要求写出计算过程) (2)固体粉末中含有的铁的氧化物可能为______或_______。 【答案】(1)解:设生成二氧化碳的质量为x Ca(OH)2+CO2=CaCO3↓+H2O 44 100 x 40g 44:100=x:40g x=17.6g 答:生成二氧化碳的质量为17.6g。 (2)Fe3O4;或FeO和Fe2O3 【解析】(1)二氧化碳与氢氧化钙发生反应生成碳酸钙白色沉淀和水,根据反应的化学方程式由碳酸钙的质量即可求得反应的二氧化碳的质量; (2)解:设铁的氧化物为FexOy,则根据题中所涉及的化学反应可列关系式: FexOy ~ y CO2 ~ y CaCO3 56x+16y 100y 23.2g 40g 56x+16y:100y=23.2g:40g 解得x:y=3:4 ①若该铁的氧化物为一种时,则为Fe3O4; ②FeO中铁与氧原子个数比为1:1>3:4;Fe2O3中铁与氧原子个数比为2:3<3:4。利用平均值法可知,若该铁的氧化物为两种时,则为FeO和Fe2O3形成的混合物。 2.(2017·安徽)实验室加热氯酸钾(KClO3)和二氧化锰的混合物28.0g制取氧气,完全反应后剩余固体质量为18.4g。请计算: (1)生成氧气的质量。 (2)原混合物中氯酸钾的质量。 【答案】(1)生成氧气的质量:28.0g-18.4g=9.6g (2)设原混合物中氯酸钾的质量为x,则 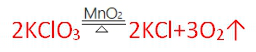 245 96 x 9.6g 245:x=96:9.6g x=24.5g 答:生成氧气的质量为9.6g,原混合物中氯酸钾的质量为24.5g。 【解析】本题为化学计算题,考查根据化学方程式的计算。 (1)根据质量守恒定律,反应前后物质的总质量不发生改变,则反应前后固体的质量差即为生成气体(O2)的质量。 (2)由氧气的质量,根据氯酸钾分解的化学方程式可计算反应的氯酸钾的质量,即混合物中氯酸钾的质量。 二、根据化学方程式计算中的表格题 1.(2017·荆门)为测定某黄铜(铜、锌合金)中铜的质量分数。称取32.5克该黄铜粉末放入烧杯中,再向烧杯内加入200克稀硫酸(足量),每隔10分钟测烧杯内(不含烧杯)剩余物质的质量,测得数据如下表:  (1)完全反应生成氢气的质量为__________________________g。 (2)计算黄铜中铜的质量分数(写出计算过程)。 【答案】(1)0.4;(2)60% 【解析】(1)由质量守恒定律可知,反应前的反应物的总质量为:200g+32.5g=232.5g,反应40分钟后反应物总质量改变为232.1g,并不再改变,说明反应已经完全,所以完全反应生成氢气的质量为200g+32.5g -232.1g=0.4g (2)设该黄铜中锌的质量为X Zn+H2SO4=ZnSO4+H2↑ 65 2 X 0.4g  答:黄铜中铜的质量分数为60%。 2.(2017·黔南)某同学用锌和稀硫酸制取氢气.向气体发生装置中加入一定量锌粒,将15g稀硫酸分三次加入,每次生成气体的质量如下表。 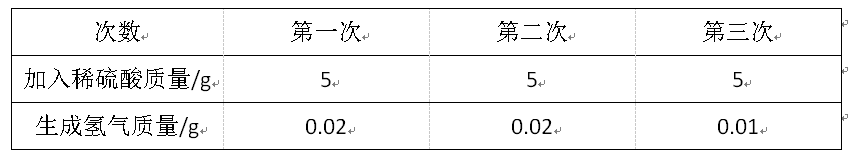 请计算: (1)共制得氢气_________g。 (2)所用稀硫酸的溶质质量分数。 【答案】(1)共制得氢气0.05g;(2)所用稀硫酸的溶质质量分数为19.6%。 【解析】根据前两次加入的硫酸可知,每加入5g稀硫酸生成的氢气为0.02g,而第三次却为0.014g,说明金属已经完全反应.所以制得的氢气的质量为0.02g+0.02g+0.01g=0.05g.根据每加入5g稀硫酸生成的氢气为0.02g和对应的化学方程式求算稀硫酸中溶质的质量分数。 解:根据前两次加入的硫酸可知,每加入5g稀硫酸生成的氢气为0.02g,而第三次却为0.014g,说明金属已经完全反应.所以制得的氢气的质量为0.02g+0.02g+0.01g=0.05g。 根据每加入5g稀硫酸生成的氢气为0.02g计算。 设所消耗的硫酸中的溶质的质量为y Zn+H2SO4=ZnSO4+H2↑ 98 2 y 0.02g 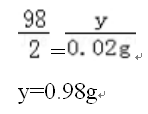 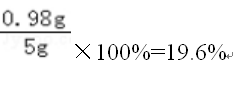 所用稀硫酸的溶质质量分数为 答:(1)共制得氢气0.05g;(2)所用稀硫酸的溶质质量分数为19.6%。 三、根据化学方程式计算中的图像题 1.(2017·河北) 用图21所示装置制取氢气并测定稀硫酸中溶质的质量分数。将稀硫酸全部加入锥形瓶中,天平示数的变化如图22所示。 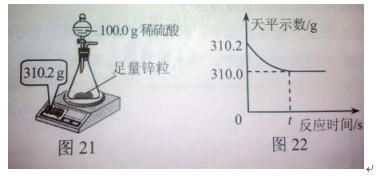 请计算: (1) 共制得氢气__________g。 (2)稀硫酸中溶质的质量分数。 【答案】(1)0.2 ; (2)9.8% 【解析】此题考察利用化学方程式结合溶液质量分数进行简单计算,从题目可以看出,锥形瓶内物质减少的质量即为反应生成氢气的质量,所以氢气质量为310.2-310=0.2g;再根据化学方程式,用氢气做已知量,求出参加反应的硫酸中溶质的质量,除以硫酸溶液质量即可。 解:100.0g稀硫酸中含溶质质量为x Zn+ H2SO4==ZnSO4+ H2↑ 98 2 X 0.2g 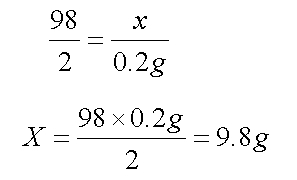 硫酸溶液的质量分数 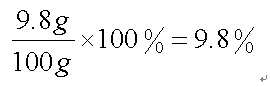 答:所用硫酸中溶质的质量分数为9.8%。 2.(2017·丽水) BaCl2是一种重金属盐,其水溶液具有很强的毒性,如误服了BaCl2溶液,可立即服用MgSO4溶液解毒,为测定某BaCl2溶液的溶质质量分数,现取100克BaCl2溶液,不断加入MgSO4溶液反应过程中溶液总质量与加入MgSO4溶液的质量关系如图所示,请回答: (1)P点时溶液中的溶质名称是 ; (2)反应生成沉淀的最大质量为 ; (3)求原BaCl2溶液的溶质质量分数。 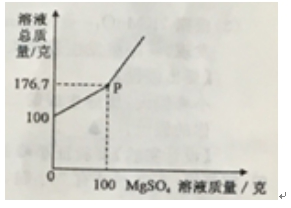 【答案】(1)氯化镁;(2)23.3克;(3)20.8% 【解析】本题主要考查的是有关化学反应的化学方程式计算。 (1)因为该反应为:BaCl2+MgSO4= BaSO4↓+ MgCl2 ,由图示可知P点时二者恰好反应,所以此时溶液中的溶质为氯化镁; (2)由图示可知二者恰好反应时消耗硫酸镁溶液的质量为100克,剩余溶液的总质量为176.7克,所以生成沉淀的质量为:100g+100g-176.7g=23.3g;(3)设BaCl2溶液的溶质质量分数为x, BaCl2+MgSO4= BaSO4↓+ MgCl2- 208 233 100g×x 23.3g 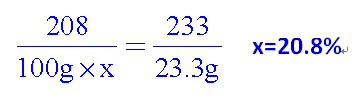 答:BaCl2溶液的溶质质量分数为20.8%。 四、根据化学方程式计算中的实验计算题 1.(2017·临沂)某化学兴趣小组在实验室用硫酸铜溶液和氯化钡溶液反应制取少量氯化铜溶液。他们的实验过程和相关数据如下(BaSO4不溶于水)。 第一步:称得烧杯的质量是100g。 第二步:反应前称得烧杯、氯化钡溶液及硫酸铜溶液的总质量是346.6g。 第三步:两者恰好完全反应后,过滤,称得烧杯及滤液的总质量是300g。 请计算:(1)反应后生成沉淀的质量是________g。 (2)所得氯化铜溶液中溶质的质量分数(写出计算过程,精确到0.1%)。 【答案】(1)46.6;(2)13.5% 【解析】本题主要考查质量守恒定律及利用化学方程式进行相关计算。 (1)由质量守恒定律可知,生成沉淀的质量=346.6g-300g=46.6g; (2)解:设生成CuCl2的质量为x BaCl2 +CuSO4 = BaSO4↓+CuCl2 233 135 46.6g x 解得x=27g 所得氯化铜溶液的溶质质量分数= 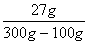 ×100%=13.5% ×100%=13.5%答:反应后生成沉淀的质量是46.6g,所得氯化铜溶液中溶质的质量分数为13.5%。 2.(2017·宿迁)牙膏中的摩擦剂可以增强牙膏对牙齿的摩擦作用和去污效果。己知某品牌牙膏中的摩擦剂是CaCO3和SiO2(SiO2不溶于水也不与稀盐酸反应)。为了测定摩擦剂中CaCO3的质量分数,通过实验测得如图数据: 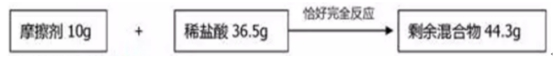 (1)生成CO2质量为______g; (2)求摩擦剂中CaCO3的质量分数。 【答案】(1)2.2;(2)50% 【解析】本题主要考查根据化学方程式的计算; (1)反应前后质量守恒,所以生成二氧化碳的质量为:10g+36.5g-44.3g=2.2g; (2)设摩擦剂中CaCO3的质量分数为x 2HCl+ CaCO3=CaCl2+H2O+CO2↑ 100 44 10x 2.2g 100:10x=44:2.2g x=50% 答:摩擦剂中CaCO3的质量分数为50%。 (责任编辑:admin) |
